来源:材料科学前沿
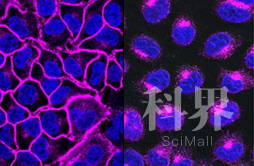
EGFR,一种帮助癌症生长的重要蛋白质,如图紫色所示
当科学家在细胞上发现一种潜在危险的蛋白质时,他们可能会设想把自己缩小成小外科医生,只切除有问题的分子,而保留细胞的健康部分完好无损。根据7月29日发表在《自然》杂志上的一项研究,尽管灵巧的双手和锋利的工具永远无法从细胞表面切除一个蛋白质,但一种新的分子工具可以使细胞手术变得更容易。 斯坦福大学的Carolyn R. Bertozzi教授课题组开发出一种新的分子,这种分子可以将不需要的蛋白质从细胞表面或周围环境传送到溶酶体中,溶酶体是用于降解蛋白质的细胞区域。这些分子被称为靶向嵌合体的溶酶体,或LYTACs,通过选择性地给蛋白质贴上标签来工作,标签决定了蛋白质的命运,使其无法被细胞垃圾处理。这种选择性降解可以帮助研究人员研究和治疗癌症和阿尔茨海默氏症等疾病,这些疾病的病因与表面蛋白质有关。
斯坦福大学的Carolyn R. Bertozzi教授课题组开发出一种新的分子,这种分子可以将不需要的蛋白质从细胞表面或周围环境传送到溶酶体中,溶酶体是用于降解蛋白质的细胞区域。这些分子被称为靶向嵌合体的溶酶体,或LYTACs,通过选择性地给蛋白质贴上标签来工作,标签决定了蛋白质的命运,使其无法被细胞垃圾处理。这种选择性降解可以帮助研究人员研究和治疗癌症和阿尔茨海默氏症等疾病,这些疾病的病因与表面蛋白质有关。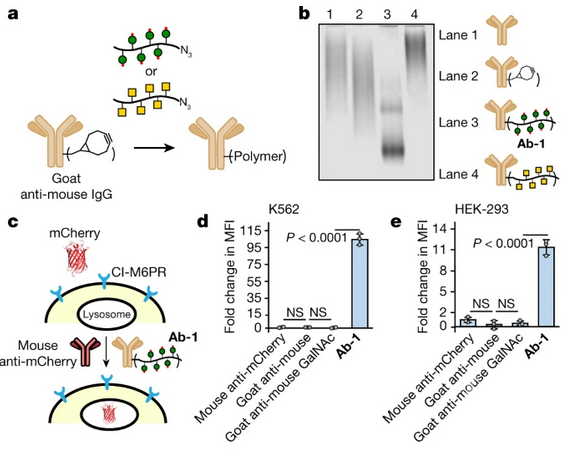 LYTACs靶向可溶性蛋白到溶酶体进行降解大多数针对单个蛋白的治疗依赖于与目标蛋白的特定活性调节相互作用,例如酶抑制或配体阻断。然而,几个主要类别的治疗相关的蛋白质有未知或无法访问活动配置文件不能被这些策略的目标。蛋白质降解平台如蛋白水解靶向嵌合体(proteolis targeting chimaeras, PROTACs)和其他平台(例如dTAGs3、Trim-Away4、伴侣介导的自噬靶向5和SNIPERs6)已经被开发用于通常难以靶向的蛋白质;然而,这些方法涉及细胞内蛋白质降解机制的操作,因此基本上局限于含有细胞内结构域的蛋白质,配体可以与这些结构域结合并补充必要的细胞成分。细胞外蛋白和膜相关蛋白占所有蛋白质编码基因的40%,是癌症、衰老相关疾病和自身免疫性疾病的关键因子,因此选择性降解这些蛋白的一般策略有可能改善人类健康。在这里,我们利用结合细胞表面溶酶体穿梭受体和靶蛋白的细胞外结构域的偶联物,确定了细胞外和膜相关蛋白的靶向降解。这些最初的溶酶体靶向嵌合体,我们称之为LYTACs,由一个小分子或抗体融合到化学合成的糖肽类配体,这些配体是不依赖于离子的甘露糖-6-磷酸受体(CI-M6PR)的激动剂。我们使用LYTACs开发了一种CRISPR干扰筛选,揭示了ci-m6pr介导的细胞系货物内化的生化途径,并揭示了外囊复合体作为这一途径的一个先前未识别但重要的组成部分。通过降解治疗相关蛋白,包括载脂蛋白E4、表皮生长因子受体、CD71和程序化死亡配体1,我们证明了该平台的作用范围。我们的研究结果建立了一个指导溶酶体降解的分泌蛋白和膜蛋白的模块化策略,对生化研究和治疗有广泛的影响。
LYTACs靶向可溶性蛋白到溶酶体进行降解大多数针对单个蛋白的治疗依赖于与目标蛋白的特定活性调节相互作用,例如酶抑制或配体阻断。然而,几个主要类别的治疗相关的蛋白质有未知或无法访问活动配置文件不能被这些策略的目标。蛋白质降解平台如蛋白水解靶向嵌合体(proteolis targeting chimaeras, PROTACs)和其他平台(例如dTAGs3、Trim-Away4、伴侣介导的自噬靶向5和SNIPERs6)已经被开发用于通常难以靶向的蛋白质;然而,这些方法涉及细胞内蛋白质降解机制的操作,因此基本上局限于含有细胞内结构域的蛋白质,配体可以与这些结构域结合并补充必要的细胞成分。细胞外蛋白和膜相关蛋白占所有蛋白质编码基因的40%,是癌症、衰老相关疾病和自身免疫性疾病的关键因子,因此选择性降解这些蛋白的一般策略有可能改善人类健康。在这里,我们利用结合细胞表面溶酶体穿梭受体和靶蛋白的细胞外结构域的偶联物,确定了细胞外和膜相关蛋白的靶向降解。这些最初的溶酶体靶向嵌合体,我们称之为LYTACs,由一个小分子或抗体融合到化学合成的糖肽类配体,这些配体是不依赖于离子的甘露糖-6-磷酸受体(CI-M6PR)的激动剂。我们使用LYTACs开发了一种CRISPR干扰筛选,揭示了ci-m6pr介导的细胞系货物内化的生化途径,并揭示了外囊复合体作为这一途径的一个先前未识别但重要的组成部分。通过降解治疗相关蛋白,包括载脂蛋白E4、表皮生长因子受体、CD71和程序化死亡配体1,我们证明了该平台的作用范围。我们的研究结果建立了一个指导溶酶体降解的分泌蛋白和膜蛋白的模块化策略,对生化研究和治疗有广泛的影响。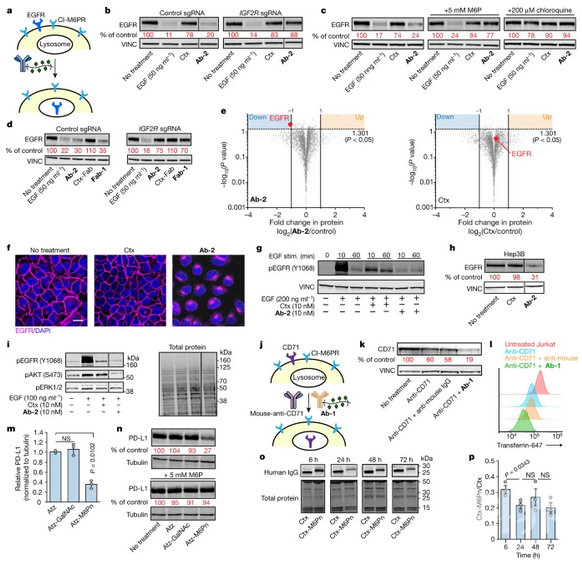 LYTACs加速膜蛋白的降解小结总之,LYTAC平台能够直接靶向细胞外和膜相关蛋白进行溶酶体降解。成功的一个特定LYTAC可能源于多种因素包括内生蛋白质动力学,固有的表面定位,易溶酶体运输通过clathrin-mediated相对于lysosome-targeting受体的内吞作用和化学计量学。尽管以上描述的LYTACs利用CI-M6PR,但原则上其他穿梭受体可以被选择,从而降低了当靶向癌蛋白时产生耐药性的可能性。我们已经证明,小分子和大肽都可以作为蛋白质靶结合物在LYTACs。调控药代动力学特性以控制脱靶清除和有效降解膜蛋白所必需的给定的LYTAC的化学量,将是进一步翻译应用的关键挑战。我们预计,LYTACs的化学可调性和模块化将为操纵这些参数对分泌蛋白和膜蛋白的靶向蛋白降解提供新的机会,无论是用于研究还是潜在的治疗。
LYTACs加速膜蛋白的降解小结总之,LYTAC平台能够直接靶向细胞外和膜相关蛋白进行溶酶体降解。成功的一个特定LYTAC可能源于多种因素包括内生蛋白质动力学,固有的表面定位,易溶酶体运输通过clathrin-mediated相对于lysosome-targeting受体的内吞作用和化学计量学。尽管以上描述的LYTACs利用CI-M6PR,但原则上其他穿梭受体可以被选择,从而降低了当靶向癌蛋白时产生耐药性的可能性。我们已经证明,小分子和大肽都可以作为蛋白质靶结合物在LYTACs。调控药代动力学特性以控制脱靶清除和有效降解膜蛋白所必需的给定的LYTAC的化学量,将是进一步翻译应用的关键挑战。我们预计,LYTACs的化学可调性和模块化将为操纵这些参数对分泌蛋白和膜蛋白的靶向蛋白降解提供新的机会,无论是用于研究还是潜在的治疗。
来源:材料科学最前沿 材料科学前沿
原文链接:http://mp.weixin.qq.com/s?__biz=MzI1NDc0NTY4OA==&mid=2247487394&idx=3&sn=8f624aa3feef112d855776d92e4f0ae6&chksm=e9c1c295deb64b8325400befeeaa45138ae904db926e795275eb7868d416a47773aab0a9fb2e&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn


