来源:CBG资讯
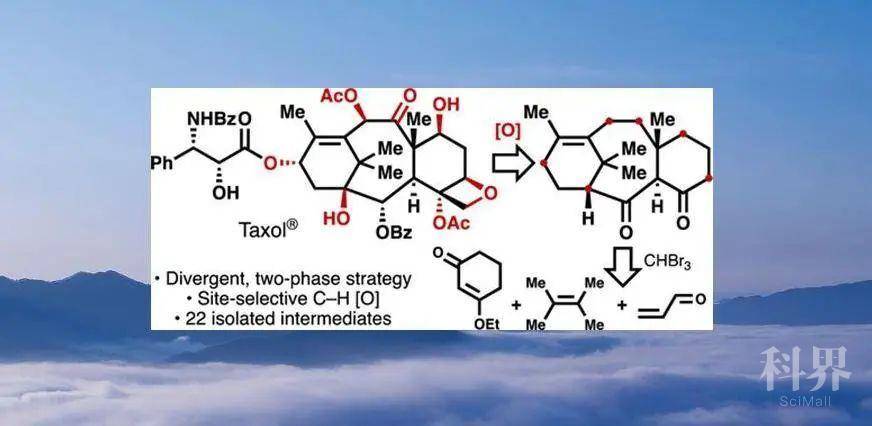
紫杉醇(taxol,1,Figure 1)是最著名的萜烯类抗癌药物,然而,临床所用的紫杉醇来源都依赖于天然(植物材料)或生物合成(合成生物学)。在结构上,高度氧化的多环二萜类骨架、中心八元环体系、反应性仲醇的选择性问题等为紫杉醇的全合成带来了巨大挑战。目前,已有7个课题组完成了其全合成,其中六种路线是通过两个化学合成的六元环稠合形成中心八元环体系,另一种是通过在已构建的八元环上进行双重环化合成。然而,上述研究均处于学术研究范围内,合成1的数量无法与每年千克级的需求量相匹配。近日,美国Scripps研究所Phil S. Baran课题组通过两相途径完成了紫杉醇的全合成,该成果发表于近期J. Am. Chem. Soc.(DOI: 10.1021/jacs.0c03592)。
学术界普遍认为复杂萜烯的生源合成是通过“两相途径”完成,即“环化酶相”和“氧化酶相”。前者通过环化酶构建C-C键形成复杂烷烃骨架,后者通过氧化酶引入C-O键。通过该策略可以构建结构多样化的类似物,从而获得不同的生物活性。因此,“氧化酶相”代表了一种极好的药物化学机制。
2009年,作者报道了一种概念,即通过模拟生物合成模式可以有效构建高度氧化的萜烯。尽管缺乏汇聚性,两相萜烯合成策略仍可用于复杂分子如ingenol、phorbol、thapsigargin等的简洁合成中。此前,该策略一直应用于非骨架重排的紫杉烷类天然产物。假设1的两相合成是一个逆合成金字塔(Figure 1),从最低氧化态的紫杉烷前体(如紫杉二烯酮9)出发至少需要9个不同的C-O键形成步骤。2012年,课题组通过简洁的“环化酶相”已实现对映体9和紫杉二烯(6)的大量合成。通过广泛的研究解释了6对烯丙基氧化的固有反应性(引入C-5、10和13),最终完成taxuyunnanine D(8)的合成。随后,将这些经验教训成功用于由9进行taxabaccatin III(7)的全合成。如上所述,氧化的挑战在于需要考虑化学、区域和立体选择性,这是大自然通过酶催化实现的。
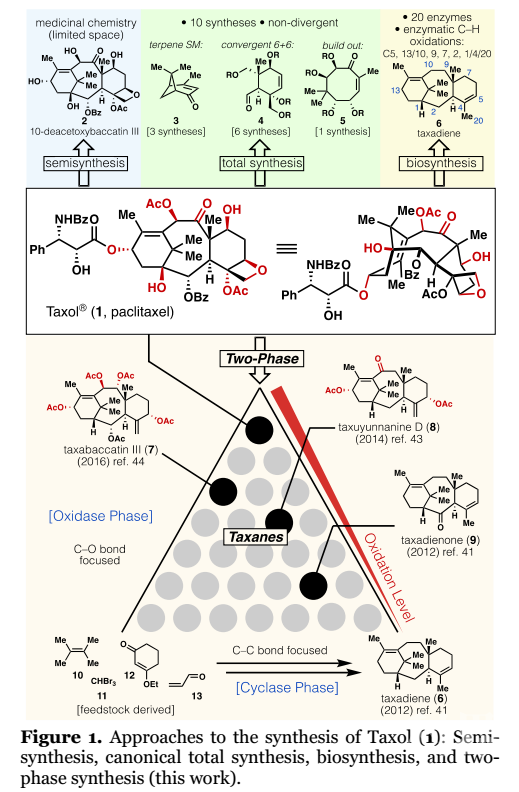
(图片来源:J. Am. Chem. Soc.)
具体的合成路线(Scheme 1):
首先,作者以简单的合成砌块10-13为原料,通过对第二代环化酶相途径进行优化:i)用替代溶剂提取挥发性中间体以简化后处理;ii)用n-BuLi代替s-BuLi;iii)用更易得的配体诱导立体化学;iv)使用操作方便且可重现的烯醇捕获操作;v)缩短反应时间;vi)开发重结晶纯化方法,制备得到110克中间体14。先前关于紫杉烷母核中烯丙基C-H键的选择性C-H官能团化经验表明,C-13氧化是可行的,并且溶剂对区域选择性控制以及使用铬氧化剂16将14转化为烯酮15至关重要。混合溶剂HFIP/TMSOH(2:1)表现出关键的协同作用,可以实现对C-13的高选择性(vs C-11)转化,得到含三个羰基的烯酮15。其无需纯化直接进行下一步反应,溴代选择性发生在C-5而非C-1、C-3、C-10或C-14,从而得到17(产率55%)。该过程的高选择性源于C-1和C-2不能烯化,并且C-14烯酸酯会形成张力桥头二烯。根据作者2014年报道的方法,C-10的自由基氧化顺利进行得到18(产率68%)。在标准条件下,用LiBr/Li2CO3消除C-5溴得到二烯酮19(产率88%)。为了给关键的C-1氧化奠定基础,作者引入了紫杉烷母核的最后一个碳原子、建立了C-13立体化学并将氘原子引入C-2,即向19中依次加入MeMgBr、DIBAL和LiAlD4(相对反应性分别由C-19、C-11和C-20甲基决定);然后引入TBS得到紫杉烷20(产率67%),其经DMDO氧化得到环氧三醇21(产率49%),为单一非对映异构体。由于C-10和C-13取代基的空间屏蔽作用,Δ11,12-烯烃得以保持稳定。Δ5,6-烯烃环氧化的立体选择性由C-19甲基决定。溶剂和反应浓度对于官能团化的选择至关重要。因此,若C-2羟基不具有β-立体化学和α-氘代或者C-4未被完全取代,则在C-1没有明显羟基化的情况下,快速氧化到C-2酮。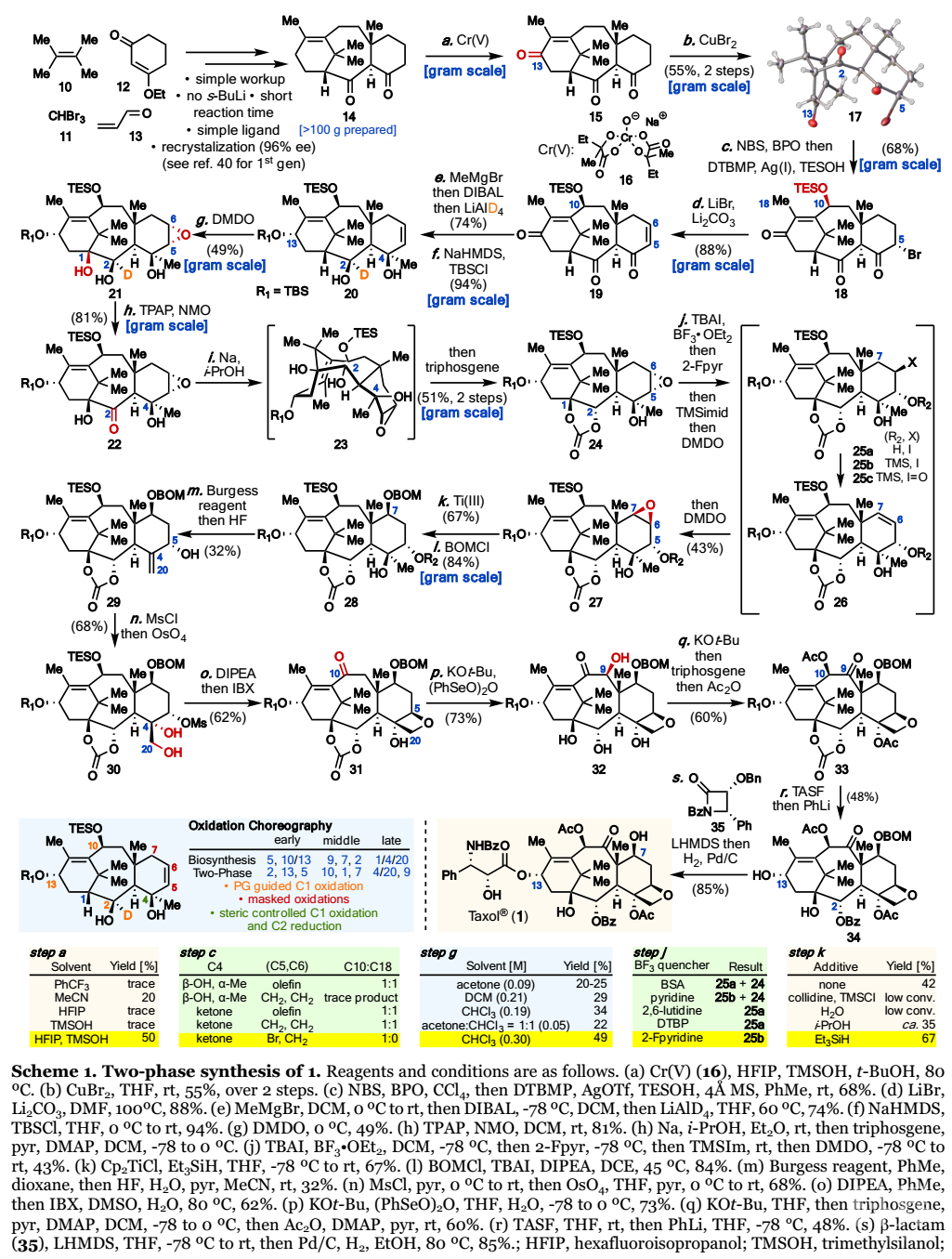

(图片来源:J. Am. Chem. Soc.)
环氧三醇21经TPAP介导的C-2氧化(22)、Na/i-PrOH热还原酮羰基(23),再加入三光气得到碳酸酯24(产率51%,两步)。紫杉烷24暴露于TBAI/BF3•OEt2中区域选择性得到相应的碘乙醇25a;然后用TMS保护C-5羟基,加入DMDO进行碘氧化并自发顺式消除得到烯烃26;再进一步立体选择性氧化得到环氧-紫杉烷27(产率43%)。由于C-7和C-5顺式氢周围的空间位阻导致构象受限,相应的碘化物25b未发生E2消除。因此,通过25c进行区域选择性消除是必不可少的。在Et3SiH存在下,环氧化物经钛介导的立体定向区域选择性还原裂解,再引入BOM得到28(产率56%);其经Burgess脱水、脱保护得到烯丙醇29(产率32%),并伴有C-5酮副产物。接下来,将烯丙醇29用MsCl活化C-5羟基后,不经分离直接进行OsO4双羟化,得到二醇30(产率68%);然后通过位阻碱DIPEA处理形成氧杂环丁烷,其C-10羟基经IBX氧化得到31(产率62%)。通过改进Holton条件(t-BuOK/H2O/(PhSeO)2O)进行C-9氧化得到32(产率73%)。通过氧化还原异构化和四次酰化再次引入环状碳酸酯和C-4/10乙酰基,得到紫杉烷33(产率60%),其经串联脱除C-13硅醚和PhLi加成得到C-7含BOM保护基的baccatinIII(34,产率48%)。最后,利用β-内酰胺35对34的烷氧基锂盐进行Ojima酰化,再氢化还原得到1(产率85%,两步)。结语: 紫杉醇(taxol)是有史以来最著名的明星天然产物,并且已成为基础科学和应用科学领域无数研究的主题。Phil S. Baran课题组通过萜类化合物两相生源合成途径即“环化酶相”和“氧化酶相”简化了紫杉醇的全合成,为仿生两相合成提供了可行的替代方法。期望该策略未来可以应用于更多萜类化合物的合成中。
来源:BeanGoNews CBG资讯
原文链接:https://mp.weixin.qq.com/s?__biz=MzI4ODQ0NjUwMg==&mid=2247504794&idx=2&sn=c7425de6051551e99b2f48a8eb51f820&chksm=ec3cd2d3db4b5bc528e4eb9dcead4fdd3aded168f09eae753e20720bbc966a0385ab4a214a67#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



