来源:BioArt
TDP-43是一种重要的RNA结合蛋白,其基因突变可引起肌萎缩性侧索硬化症(ALS,俗称“渐冻人症”)。在正常细胞中,TDP-43蛋白主要弥散分布于细胞核内,但可穿梭至胞浆并与其它蛋白相互作用形成应激颗粒等各种核糖核蛋白复合物,参与RNA剪切、成熟、加工、运输、转运、翻译、降解等多个步骤的调控。在疾病状态下,TDP-43在胞浆中形成异常蛋白聚集被认为与ALS的发生发展密切相关。近期研究显示液-液相分离(LLPS)介导了无膜、液滴状的应激颗粒的生成,而其异常相变被认为是导致胞浆形成TDP-43蛋白聚集并引发ALS的关键致病机制之一。需要指出的是,细胞应激时尽管部分TDP-43蛋白被招募到胞浆中参与应激颗粒的组装,但绝大部分的TDP-43依然驻留在细胞核内。遗憾的是,核内TDP-43在细胞应激时的反应及其在ALS发病中的作用长期以来被忽视和低估。
2020年7月9日,中科院上海有机化学研究所生物与化学交叉研究中心方燕姗研究员课题组和刘聪研究员课题组合作,在Molecular Cell在线发表题为“Stress induces dynamic, cytotoxicity-antagonizing TDP-43 nuclear bodies via paraspeckle lncRNA NEAT1-mediated liquid-liquid phase separation”的最新论文。该研究揭示了不同类型的RNA精密调控TDP-43的相分离状态,使其在细胞应激时于核内形成具有细胞保护功能的无膜、液滴状、高度动态且可逆的核颗粒,该研究团队将之命名为“TDP-43核体” 。

这项研究表明TDP-43核体是通过TDP-43蛋白的液-液相分离所形成,这一过程被RNA严格调控。TDP-43蛋白序列中的两个RNA识别域RRM1和RRM2分别发挥着不同甚至相互拮抗的“向心–离心”作用,因而缺乏RRM1或RRM2的TDP-43核体分别展现出有趣的“核”-“环” 形态。总RNA对TDP-43蛋白相分离具有抑制作用,这与细胞核中相对“抑制性”的微环境一致,因此很少看到正常细胞自发形成的TDP-43核体。该研究团队发现,细胞应激时神经元中长链非编码RNA (lncRNA) NEAT1 的水平明显升高而且与TDP-43核体共定位。体外实验结果显示NEAT1可以明显促进TDP-43蛋白相分离的发生,并且下调细胞中NEAT1水平会显著减少应激细胞中TDP-43核体的形成,因此证明NEAT1对于TDP-43形成应激核体具有重要调控作用(图1)。
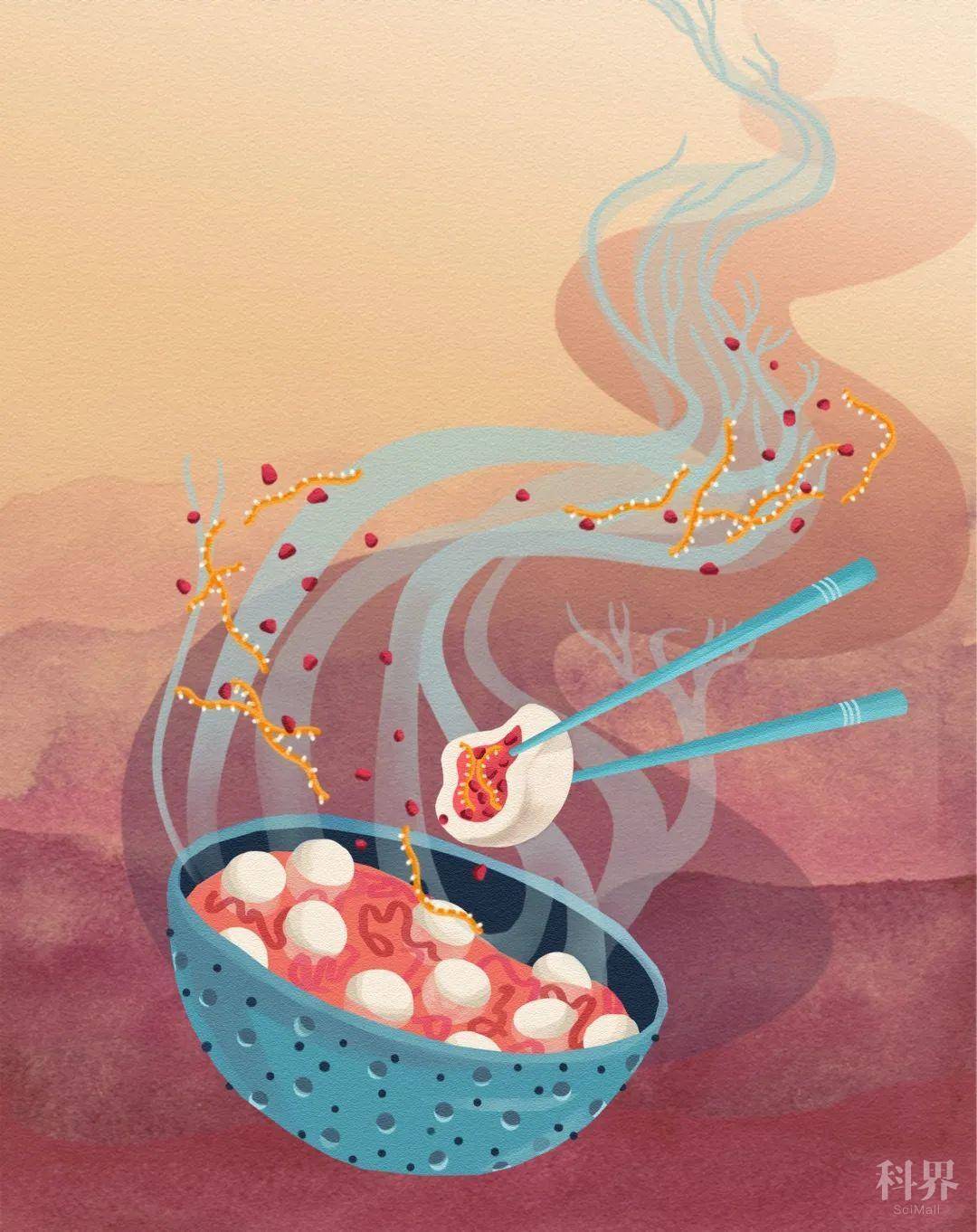
图1. 细胞核(碗)中的TDP-43核体形似“牛筋肉圆”,在应激(加热)时lncRNA NEAT1(牛筋)促进TDP-43蛋白(肉馅)相分离形成,其中蒸汽的阴影象征性的代表神经元的形状(该图由方燕姗构思、贺赫设计绘制
更重要的是研究人员在这项工作中进一步发现,与所有其它已知的ALS致病突变主要集中在影响蛋白-蛋白相互作用的功能域不同,TDP-43蛋白的D169G位突变(存在于ALS病人中)位于其RNA识别域RRM1中,并能严重影响lncRNA NEAT1促进TDP-43相分离和核体组装的功能,导致细胞应激时有更多TDP-43蛋白从核内转移至胞浆中,持续应激下进一步发展成具有ALS病理特征的高度磷酸化的TDP-43蛋白聚集体(图2)。与此一致的是D169G突变的TDP-43在人源细胞和果蝇模型中均引起比野生型TDP-43更强的细胞毒性和神经退化的表型。
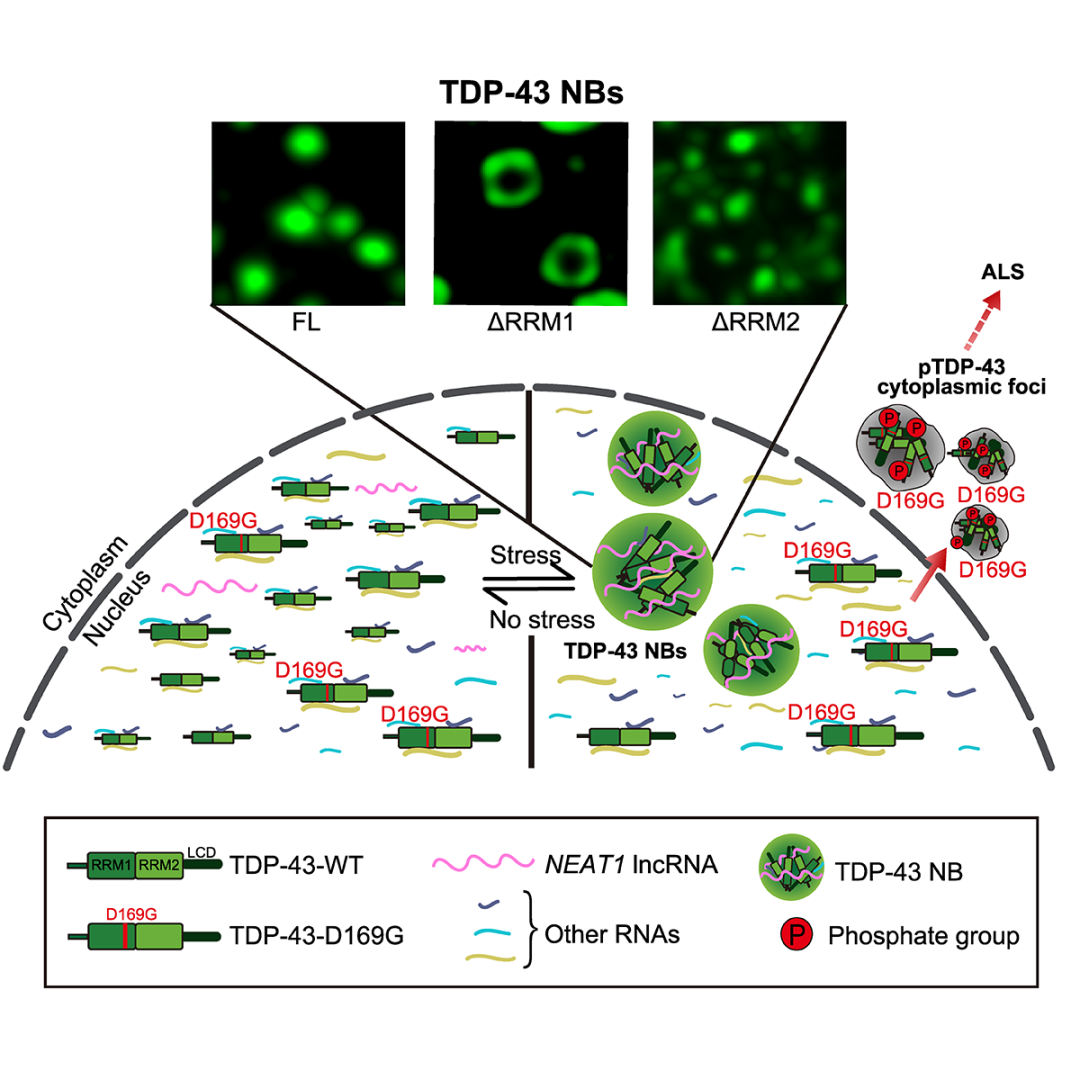
图2. TDP-43核体响应细胞应激和参与ALS疾病发生的分子机制示意图
“过去十余年间,这个领域的大量工作聚焦在TDP-43等RNA结合蛋白的异常出核以及对胞浆中应激颗粒的生成和异常。此项发现提示着TDP-43核体的形成或许是细胞应激时的 ‘第一防线’,其组装或功能异常可能与ALS的发生有重要关系。我很高兴我们的工作能突破惯性思维的限制,为ALS发病机制和治疗策略的研究提供新的思路和视角”,文章的主要通讯作者方燕姗研究员说。
该论文的共同第一作者是中科院上海有机所生物与化学交叉研究中心研究生王晨、段永嘉和段钢,方燕姗研究员和刘聪研究员为共同通讯作者。参与该项研究的还有美国Thomas Jefferson大学的郭琳教授。
另外值得一提的是,该工作的联合团队方燕姗课题组与刘聪课题组一直长期深入合作,致力于系统性研究蛋白质相分离的调控及其紊乱在神经退行性疾病中的作用。除了此次揭示RNA调控蛋白相分离从而促进TDP-43核体形成之外,该合作团队还于2019年在Cell Research上发表论文,报道细胞内蛋白翻译后修饰——多聚ADP核糖基化 (PARylation) 对于ALS致病蛋白hnRNP A1的动态相分离的调控,并进一步阐释了多聚ADP核糖基化修饰对于hnRNP A1在细胞核质间转运、参与应激颗粒组装以及形成致病淀粉样聚集中的关键作用。

来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652490712&idx=5&sn=0bb13ed07ee23a4a423b1ecdb6a407c1&chksm=84e2586cb395d17a72471f81891621da198e26ffba839efed8fca907d52797ae628267b0443f#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



