来源:BioArt
自CRISPR-Cas系统的机制被厘清并被改造用于真核细胞的基因编辑之后,相关基因编辑工具的开发、改造和应用呈现出爆炸式的增长,这也让终极梦想—“随心所欲”的精准基因编辑—不再遥不可及。目前而言,CRISPR-Cas相关的工具在基因编辑、转录调控、表观遗传学修饰、RNA编辑(详见BioArt报道:『珍藏版』综述 | RNA靶向的CRISPR系统——从宏基因组到RNA调控 )和核酸检测等多个研究领域均有重要应用。近年来以改变基因组DNA序列为目标的基因编辑工具的开发更是突飞猛进:除最基本的Cas核酸酶外,单碱基编辑器(base editors)、Cas转座及重组酶系统和引导编辑器(prime editors)的出现让基因编辑有了更多选择。不同的基因编辑工具各有其适用场景,此外,研究者也正针对各类工具在编辑活性、编辑范围和编辑特异性中的不足之处加以改进,这让CRISPR-Cas相关的基因编辑工具更加多样化,却也让工具的合理选择和针对性优化更具挑战性。 2020年6月22日,来自美国哈佛大学与麻省理工学院Broad研究所的David R. Liu实验室在Nature Biotechnology发表题为Genome editing with CRISPR–Cas nucleases, base editors, transposases and prime editors的综述。文章重点关注CRISPR-Cas相关的基因编辑工具,分别对Cas核酸酶、单碱基编辑器、Cas转座及重组系统和引导编辑器(图1)的编辑特性、应用场景及近来的发展态势进行了总结,希望此文能为CRISPR-Cas系统的应用和研究人员在工具的合理选择和针对性优化过程中提供指导。
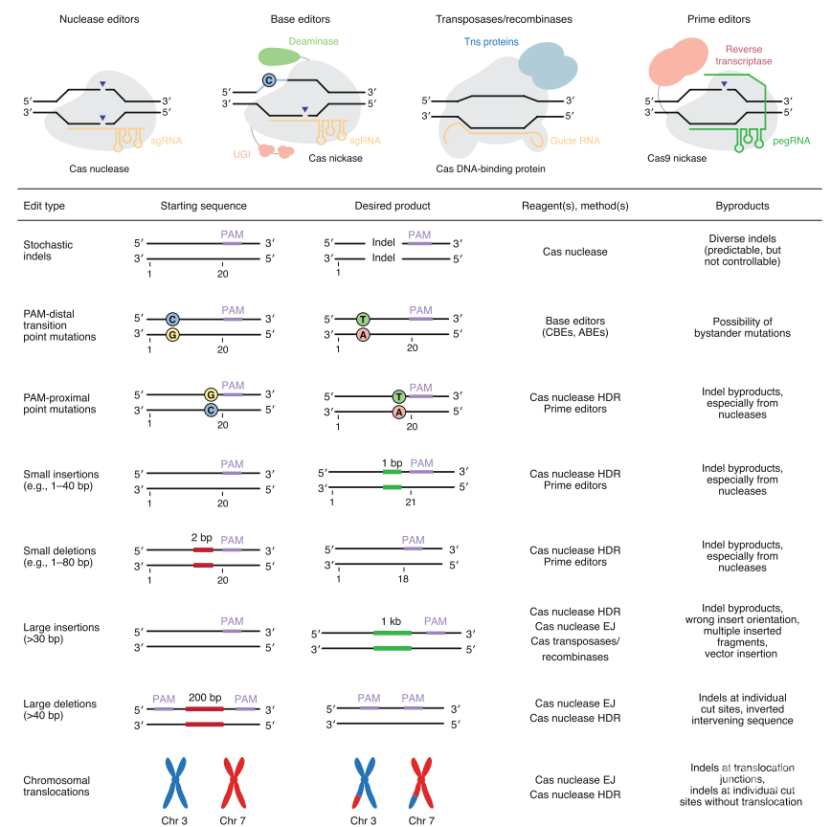 图1 本文所关注的基因编辑系统
图1 本文所关注的基因编辑系统CRISPR-Cas核酸酶介导的基因组编辑
CRISPR-Cas系统是细菌和古细菌的适应性免疫系统,因其向导RNA的可编程特性和Cas核酸酶在多种细胞和组织中的明显活性而被广泛用于基因编辑研究。本小节着眼于自然界中发现的多种Cas核酸酶,对其在基因编辑中的多种应用方式进行总结,并对以拓展编辑范围和增加酶切特异性为目标的各种Cas突变体的开发加以汇总。 目前的研究表明,自然界中的CRISPR-Cas系统可分为两大类:1型借助于多蛋白复合物实现核酸的切割;2型则依赖于单一的蛋白核酸酶实现切割。考虑到单一核酸酶的应用优势,2型CRISPR系统被广泛用于生物医学的基础和转化研究。此外,根据Cas核酸酶的不同,类型2可细分为II、V和VI三种亚类,其中大多数II型Cas9和V型Cas12 具有RNA介导的DNA内切酶活性;而VI型Cas13蛋白则具有靶向和切割RNA的能力。此处将着眼于能实现DNA编辑的Cas9和Cas12核酸酶。 Cas9核酸酶 自然界中,Cas9需要依赖于两条短链的 crRNAs(CRISPR来源的RNAs)和 tracrRNA(反式作用的crRNA)方能形成功能性的核糖核蛋白复合物发挥切割双链DNA的功能。而后研究者将crRNA与tracrRNA融合获得单链向导RNAs(sgRNAs),sgRNA可引导Cas9定位至含特定PAM序列的靶位点DNA处,随后开启双链DNA的解旋并诱导RNA-DNA杂合链的形成。此过程中,非互补的DNA链被向导RNA替换,最终形成单链DNA的“R-loop”结构。Cas9切割双链DNA时,主要在PAM位点上游3bp处引入平末端的DSBs。 R-loop的形成会改变Cas9构象而激活其核酸酶功能域,最终诱导DNA双链断裂(DSBs)。Cas9对DNA双链的切割分别依赖于HNH和类RuvC两大功能域。失活单一的核酸酶功能域可获得Cas9单切口酶;而同时失活两种核酸酶功能域则可获得仍保留结合DNA能力的失活型Cas9(dCas9)。 目前用于真核生物基因编辑的Cas9同源蛋白众多,它们在大小、PAM特性、向导RNA结构、间隔序列长度、编辑效率和编辑特异性上各有特点。这让研究者在应用中有了更多选择。 Cas12核酸酶 与Cas9不同,Cas12核酸酶只有单一的类RuvC核酸酶功能域发挥诱导DSBs的功能。Cas12核酸酶依赖于单一的crRNA引导实现DNA定位,并在原间隔序列的远PAM端切割并产生粘性末端,这与Cas9通常在近PAM端切割产生平末端的特性恰好相反。 Cas12a(早期被命名为Cpf1)是最早被发现并广泛用于基因组编辑的Cas12核酸酶,它可以通过自身的RNA酶功能域对包含多个crRNA的表达阵列进行剪切,从而实现多基因同时编辑。此外,多种Cas12同源蛋白在完成对目标位点的识别并激活内在的核酸酶活性之后,会无差别的切割单链DNA和RNA,这一特性可被用于核酸检测(详见BioArt报道:一个悲喜参半的故事丨植生所王金博士等报道Cas12a对于靶标ssDNA和非靶标ssDNA的切割特性研究 )。 修复通路 细胞内存在多种DSBs的修复机制,细胞类型、细胞状态以及DSBs的特性均会影响修复机制的选择。总体而言,DSBs修复机制可分两大类:一是断裂的DNA双链末端连接,此过程中通常会随机引入插入缺失突变;另一类则是DNA模板介导的同源重组修复(HDR)。在绝大多数哺乳动物细胞中,末端连接途径占据主流,而HDR则通常只在分裂的细胞中发挥修复作用,且依赖于多种主要在细胞S期和G2期表达的蛋白。 总体而言,CRISPR-Cas核酸酶诱导的DSBs主要由末端连接介导的易错通路加以修复。为增强HDR介导的修复效率,研究者尝试过多种策略,一种策略是使用Cas9单切口酶抑制DSBs的形成并增强HDR修复效率;此外,HDR修复效率还可通过基因沉默、小分子抑制剂或蛋白过表达等方式抑制非同源末端连接修复或增强HDR通路活性等策略加以提高。不过,考虑到DNA修复蛋白的重要性,这类策略通常难以用于在体研究。为改善HDR修复的效率,研究者还尝试多种其它策略,或对DNA模板加以优化,或促进模板DNA在DSBs位点的富集,或增强细胞周期的同步化,或使用AAV病毒基因组做模板。虽然这类策略可不同程度的改善HDR修复效率,绝大多数情况下,细胞内DSBs修复的主要途径依然是非同源末端连接介导的易错修复,这在非分裂细胞中尤为明显。 值得注意的是,除了激活DNA修复通路,细胞内DSBs的产生还可能引发不可预知的安全风险:导致非必要的基因组改变如染色体易位和大片段缺失,p53通路的活化等等(详见BioArt报道:NBT丨CRISPR编辑技术面临新的安全隐患——胡家志点评;特别关注丨 CRISPR-Cas9系统的新风险——破坏DNA-PK依赖的修复通路引发DNA损伤;Nat Genetics | Cas9蛋白本身可激活p53通路并促进p53失活型突变的择性富集),这种潜在的安全风险提示我们,CRISPR-Cas系统仍有诸多有待优化之处。 拓展编辑范围为目的的Cas9突变体的开发 在CRISPR-Cas技术的研发过程中,拓展其编辑范围是研究的主要方向之一。Cas蛋白要实现DNA定位,主要依赖于PAM序列。目前发现的多种Cas9及Cas12同源蛋白对PAM序列的要求各不相同,这种多样性也被研究者充分利用,以拓展基因组的可编辑范围。不过目前PAM序列依然严重限制了CRISPR-Cas系统的应用,使得基因组的很大一部分难以被编辑。为此,众多研究者努力的改造优化Cas9和Cas12蛋白,以求最大程度的解除PAM对其应用的限制(详见BioArt报道:特别推荐丨基因魔剪CRISPR/Cas9新进展——新型利器xCas9 3.7利刃出鞘;NBT | 升级版ScCas9——高活性、高特异性与更好的PAM兼容性;Science | 摆脱PAM困扰—Cas9强势升级获得基因编辑新利器SpRY)。 目前,自然界来源的Cas同源蛋白及其各种突变体可识别的PAM特征序列已经过半,这标志着该领域已取得长足进步。不过,进一步改善Cas蛋白的编辑范围依然任务艰巨,这其中尤以非嘌呤PAM序列的识别最具挑战性。目前的研究多集中于SpCas9编辑范围的拓展,不过Cas12同源蛋白及突变体的研究依然值得重视。此外,研究者还注意到,Cas突变体的活性普遍不如其野生型蛋白,这在人类疾病动物模型的研究及部分内源蛋白结合的DNA位点处尤为显著。因此,构建更具活性的Cas突变体并进一步拓展其PAM特征序列将是未来研究的重要方向。 改善编辑特异性为目的的Cas9突变体的开发 Cas核酸酶介导的精准编辑依赖于其区分靶位点和高相似度非靶位点的能力。虽然部分Cas9及Cas12同源蛋白本身具有较高特异性,当下研究的热点之一依然是开发Cas突变体以增强其区分靶位点序列和高相似度非靶位点的能力,从而提高Cas系统的编辑特异性。当下可检测Cas核酸酶脱靶活性的高灵敏度方法的开发极大的推动了高特异性Cas突变体的研究。 改善编辑特异性的思路之一是借助于结合于临近位点的两个Cas9以诱导单一的DSB。此外研究者通过构建Cas9的突变体为改善Cas9蛋白本身的编辑特异性。除针对Cas蛋白进行突变外,研究发现对sgRNAs进行优化有助于脱靶活性的降低(详见BioArt报道:Nat Biotech丨提高CRISPR特异性的新方法)。 尽管高特异性Cas突变体的研究取得了长足进步,研究者注意到,这类突变体的靶位点编辑活性常不尽如人意。此外,大多数高特异性Cas9突变体对向导RNA有更高要求,向导RNA的些许改变很可能导致其活性的丧失。这一系列不足之处极大的限制了高特异性Cas9突变体的应用,因此对CRISPR-Cas系统进行进一步的优化,在降低脱靶活性的同时保持其有效的靶位点编辑活性,并保障系统与各类向导RNA变体的兼容性,是未来研究的重要方向。单碱基编辑器介导的基因组编辑
单碱基编辑器无需诱导DSBs和补充DNA模板的条件下便可实现靶位点的精准点突变,且该过程不依赖于HDR修复途径。目前可用的单碱基编辑器是将活性受损的CRISPR-Cas核酸酶(无诱导DSBs的能力)与单链DNA脱氨基酶融合而得,特定条件下,还需融合可调控DNA修复机制的蛋白。现有的单碱基编辑器有两大类:一类是融合胞苷脱氨基酶的胞嘧啶碱基编辑器(CBEs),可催化C·G--T·A碱基对的转换;另一类则是融合优化过TadA*脱氧腺苷脱氨基酶的腺嘌呤碱基编辑器(ABEs),可实现A·T--G·C碱基对的转换。CBEs和ABEs可有效介导四种碱基转换突变(C-T,A-G,T-C和G-A),这类突变约占目前人类致病变异的30%。目前单碱基编辑器被广泛用于多种细胞系和模式生物中,并用于多种人类遗传病动物模型的构建和治疗(详见BioArt报道:异军突起:单碱基基因编辑技术)。 单碱基编辑过程中目标核苷酸的单碱基编辑依赖于脱氨基酶与底物核苷酸的结合,其中可被有效编辑的核苷酸位置被定义为单碱基编辑的“活性窗口”。对于以SpCas9为基础的经典CBEs和ABEs,其活性窗口主要位于前间隔序列的第4-8位(前间隔序列的起始核苷酸定义为1位,PAM定义为21-23位),当然,活性窗口并非完全固定,还会受到DNA状态如染色体结构的影响。 活性窗口中底物核苷酸的脱氨基化会导致尿嘧啶和次黄嘌呤的形成,为改善单碱基编辑的效率, CBEs系统中通常会进一步融合尿嘧啶糖基化酶抑制剂(UGIs)蛋白以抑制细胞对基因组中尿嘧啶碱基的修复。此外,多数单碱基编辑器均采用Cas单切口酶以切断未编辑的DNA链,从而促进以发生编辑的DNA链为模板的修复,最终促进靶位点碱基对的稳定编辑。研究者还发现,对融合蛋白间的接头序列加以优化,或增加UGI功能域的数目可进一步提高CBEs的编辑效率。而通过核定位序列的增加和密码子优化可进一步提高编辑效率。除此之外,研究者还针对单碱基编辑器的编辑范围、编辑效率及产物的纯度做了更多优化。 单碱基编辑器编辑范围的拓展 单碱基编辑器借助于Cas蛋白实现DNA定位,进而实现靶位点处特定活性窗口内目标核苷酸的精准编辑。因此,PAM序列对单碱基编辑器的编辑范围有重要影响。为此早期研究者致力于使用可识别不同PAM的Cas同源蛋白和突变体以拓展单碱基编辑器的编辑范围。 此外,通过将脱氨基酶与不同的Cas同源蛋白融合,研究者可获得小型化的单碱基编辑器以用于AAV病毒的包装和递送。此外,研究者还利用内含肽对单碱基编辑系统加以拆分,从而可通过双AAV系统实现高效的在体单碱基编辑。 考虑到各类基因编辑工具的靶位点编辑效率因位点、细胞类型和细胞状态而异,开发更为多样化的单碱基编辑工具对单碱基编辑的未来应用有重要意义。 R-loop与脱氨基酶相互作用的调整 R-loop和单链DNA的形成是单碱基编辑器发挥功能的关键。脱氨基酶与R-loop的相互作用对单碱基编辑器的效率有决定性影响。通常活性窗口位于R-loop中最易接近的核苷酸位点。研究者发现,更换不同类型的Cas蛋白或脱氨基酶对活性窗口也有重要影响。这或许是因为Cas蛋白和脱氨基酶的改变会对R-loop与脱氨基酶的相互作用产生重要影响。 当下关于Cas同源蛋白及其突变体的研究进展迅速,适用于单碱基编辑的脱氨基酶及其突变体的筛选也取得重要成果,它们之间的不同组合极大的丰富了单碱基编辑的工具箱,也让R-loop与脱氨基酶之间的相互作用有了更多变化,由此获得的单碱基编辑器也拥有了更为多样化的活性窗口,这让单碱基编辑器更具应用潜力。 单碱基编辑脱靶风险的改善 单碱基编辑的脱靶效应较为复杂,除非靶位点的突变外,还包括靶位点处目标碱基的颠换(C·G—[A·T或G·C]; A·T—[T·A或C·G]),靶位点处非目标碱基的突变及靶位点处的插入缺失突变。 碱基颠换突变常见于CBEs中,源自DNA糖基化酶切除DNA中尿嘧啶产生的无碱基位点的易错修复。研究者发现,增加UGI的拷贝数或促进其表达有助于降低碱基颠换的发生频率。 靶位点处非目标碱基的突变与单碱基编辑器的活性窗口关系密切。活性窗口过宽易引入非目标碱基的突变,研究者已开发出多种活性窗口更窄的CBEs以降低非目标碱基的突变风险,但针对ABEs的相关研究目前较为匮乏。 目前应用较为广泛的单碱基编辑器多依赖于Cas单切口酶,这极大的降低了靶位点插入缺失突变发生的风险。不过脱氨基化的碱基在修复过程中易导致编辑链的断裂,而Cas单切口酶则多作用于非编辑链,因此单碱基编辑过程中依然存在DNA双链断裂的可能。为进一步降低靶位点处插入缺失突变发生的风险,研究者尝试在CBEs系统中融合Mu Gam蛋白以保护DSBs末端。此外,将单切口酶替换为失活型Cas同样能有效降低插入缺失突变的风险,不过也会降低靶位点的编辑效率。 除靶位点的脱靶风险外,单碱基编辑器在DNA和RNA的非靶位点处同样存在脱靶效应。其中DNA水平的脱靶效应可分为Cas依赖型和Cas非依赖型脱靶。Cas依赖型脱靶在ABEs和CBEs均有发生,可通过使用高特异性的Cas蛋白及突变体、截短型sgRNA和RNP复合物递送而优化,此外,通过蛋白质工程对脱氨基酶进行改造也可以优化Cas依赖型的脱靶效应。Cas非依赖型脱靶源自脱氨基酶与细胞内基因组中瞬时存在的单链DNA的相互作用,主要发生在CBEs系统中。目前研究者主要通过构建脱氨基酶突变体和不同类型的脱氨基酶筛选对此加以优化。 由于CBEs和ABEs系统中的脱氨基酶多可作用于RNA的碱基发挥脱氨基作用,早期开发的单碱基编辑器多在RNA水平存在明显的脱靶效应。目前研究者多通过蛋白质工程构建脱氨基酶的突变体以降低其在RNA水平的脱靶风险。 选用单碱基编辑器的注意事项 现有的单碱基编辑器种类繁多且各具特色。单碱基编辑器种类的多样化让研究者有更多选择空间,却也让单碱基编辑器的合理选择更具挑战性。总体而言,选用单碱基编辑器时须考虑多种因素,包括靶位点附近PAM的可用性,位点的碱基序列特征,活性窗口,编辑后产物的单一性和DNA特异性,只有将各关键因素综合考量方能选到合适的单碱基编辑器。当然近年来人工智能和机器学习的飞速发展也让基因编辑模型的构建有了诸多进展,这对工具的合理选择有重要指导意义。 单碱基编辑器介导的靶位点随机突变 除精准编辑之外,在特定条件下,单碱基编辑器还适用于靶位点的随机突变。策略之一是使用无UGI融合的CBEs系统;另一种策略则是将胞苷脱氨基酶与腺嘌呤脱氨基酶同时融合于单一的Cas蛋白,由此获得的单碱基编辑器可同时诱导C-T和A-G突变(详见BioArt报道:专家点评4篇NBT | “”双剑合璧——李大力组开发新型双碱基基因编辑器)。此外,多种胞苷脱氨基酶的串联融合,或是借助于MS2和Suntag系统构建的多组分单碱基编辑器亦可实现靶位点的随机突变。有研究者还尝试将易错DNA多聚酶与Cas9单切口酶融合,获得的碱基编辑工具EvolvR在大肠杆菌中可成功实现靶位点随机突变,且编辑窗口可达350bp。 单碱基编辑器的未来展望 在诸多研究者的努力下,单碱基编辑研究进展迅速且极具临床应用潜力。目前而言,单碱基编辑器在编辑效率、编辑特异性和在体递送等方面仍有待进一步优化。此外,开发活性可控的单碱基编辑器亦将拓展其在基础研究和临床治疗中的应用前景。 考虑到单碱基编辑的独特机制,以及现有单碱基编辑器CBEs和ABEs在多种分裂细胞、非分裂细胞和在体模型中的优良特性,开发可实现碱基颠换的单碱基编辑工具依然让人期待,这对基因编辑的未来发展有非常重要的意义。转座酶和重组酶介导的基因编辑
活细胞基因组中的定向整合一直极具挑战性。虽然核酸酶和单切口酶介导的HDR可实现基因组中的定向整合,但仅局限于可分裂的细胞。近年来研究者发现自然界中存在CRISPR转座酶系统可实现细菌基因组中的定向整合;研究者还将Cas蛋白与转座酶融合,同样可实现细菌基因组中的定向整合。此外,研究者还将Cas蛋白与重组酶融合,可在人源细胞中实现目标DNA片段的删除。 CRISPR转座酶系统 对CRISPR系统多样性的探索让研究者发现了可在细菌中适用的CRISPR转座酶系统(详见BioArt报道:专家点评Science+Nature长文| 当CRISPR遇上转座子——实现位点特异性DNA片段的高效、特异插入)。 dCas-转座酶及重组酶融合系统 将转座酶或重组酶与dCas9融合或有助于定向转座和重组。目前而言,dCas-转座酶融合系统可在大肠杆菌中发挥一定效果;而dCas-重组酶融合系统则能在哺乳动物细胞中实现目标DNA片段的删除,当然,其编辑效率不尽如人意,且适用范围相当有限。 CRISPR转座酶及重组酶系统的未来发展 CRISPR转座酶及重组酶系统依然处于起步阶段,虽然CRISPR转座酶系统在体外和细菌系统中的效果令人欣喜,但其仍难以在哺乳动物细胞中发挥功能。因此,深入探究CRISPR转座酶系统的作用机制并开发真核细胞可用的定向转座系统将是基因编辑领域的重大突破。引导编辑(Prime editing)
基因编辑的很多应用场景,特别是哺乳动物基因组中致病突变的诱导和修复,依赖于包括点突变、小片段插入和缺失突变在内的精准基因编辑。如上文所述,CRISPR-Cas核酸酶可诱导DSBs,在末端连接修复途径下可实现DNA序列的删减和破坏;而在HDR途径下则可实现精准修复,不过常伴有严重的插入缺失脱靶突变。单碱基编辑可在不诱导DSBs的条件下实现精准的单碱基编辑,但只能诱导碱基转换而无法实现碱基颠换。当然,单碱基编辑也无法实现精准的插入缺失编辑。此外,单碱基编辑器常会导致靶位点非目标碱基的脱靶突变,且部分位点由于缺乏合适的PAM序列而难以实现目标碱基的精准编辑。 2019年出现的引导编辑有着广谱的编辑能力,理论上可精准诱导所有类型的单碱基突变、小片段插入和缺失突变 (详见BioArt报道:专家点评Nature | David Liu再出重磅基因编辑新工具,可实现碱基随意转换与增删)。 虽然引导编辑的效果令人惊喜,但依然有诸多关键问题有待解决。这包括细胞状态及细胞类型对引导编辑效率的影响;引导编辑过程中涉及的DNA修复机制以及如何实现引导编辑系统的在体应用。此外,现有的引导编辑系统中逆转录酶体积过大,这并不利于系统的广泛应用。因此,探寻适用于引导编辑的小型逆转录酶对其未来应用相当关键。 总结而言,本综述对以改变基因组DNA序列为目标的CRISPR-Cas相关的基因编辑系统进行了系统且详实的总结,这可让我们对CRISPR-Cas相关的基因编辑系统有较全面的认识,也为基因编辑工具的合理选用提供了重要指导。此外,本综述对领域面临的困难与挑战进行了分析,并对基因编辑研究的未来方向给出了很有深度的见解。来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652488782&idx=1&sn=37636428e378a1307bd632750e5a0f79&chksm=84e257fab395deecfb1502549f0de7547877ade94ef8ee8cd35df7c73829b3639b4447c1b020#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn


