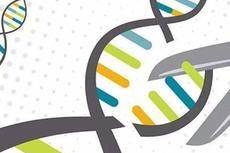
▲CRISPR/Cas9介导眼色素相关基因敲除使蚊子眼睛从黑变白。来源:Michelle Bui,加州大学河滨分校。
加州大学河滨分校的研究人员培育出了在生殖系稳定表达Cas9酶的转基因蚊子。使基因编辑工具CRISPR能够对蚊子的DNA进行高效、特异的编辑。
埃及伊蚊是登革热、切昆贡亚热、黄热病和寨卡病毒的主要媒介,并对杀虫剂具有耐药性。研究人员使用CRISPR系统干扰其表皮,翅膀和眼睛的发育,产生黄化,三眼和无翅蚊子。他们的最终目的是利用表达Cas9的蚊子连同基因驱动技术插入并传播特定基因,抑制蚊子发展,并避免耐药进化。这项研究由在加州大学河滨分校农业与自然科学学院任职的昆虫学副教授Omar Akbari领导并于11月15日在PNAS出版。

▲CRISPR/Cas9介导的表皮色素相关基因敲除使蚊子从黑色变成黄色;与眼色素相关基因的敲除使蚊子的眼睛从黑变白。来自:加州河滨分校。
之前利用基因编辑防止蚊子传播病原体的工作一直因突变率低、存活率低以及突变基因不能传代而受到限制。令人高兴的是,Akbari和同事们研发了生殖系稳定表达Cas9的转基因蚊子,使CRISPR系统能高效的编辑其基因组。CRISPR就像一把分子剪刀,在RNA引导下切割特定的DNA序列。
基因驱动大幅增加了特定基因传递给后代的几率,可从50%提高到99%。当采用倍增技术,即在多个位点敲除靶基因,这个数字可能会增加到100%。最近Akbari和他的同事们用计算机模拟了该项技术。基因驱动系统有利于使基因遗传偏向于迅速扩散的,使蚊子自我毁灭的基因(如破坏生育能力的基因),这可能是一种高效控制疾病传播昆虫的方法,且对环境无害。
“这些蚊子种群代表使用基因驱动系统控制蚊子的数量和减少疾病传播的第一步。”Akbari说,“下一步要识别基因组中可用于表达引导RNAs调控序列,一旦这些序列被确定,在物种发展基因驱动系统会非常简单。”
科界原创
编译:花花 编辑:张梦
来源:www.phys.org