来源:X一MOL资讯
受限于核糖体的线性模板合成机制,化学拓扑在蛋白质工程中一直是相对被忽视的话题。随着研究的不断深入,人们发现了越来越多具有非线性结构的天然拓扑蛋白质。它们通常具有与其拓扑结构相对应的功能优势,在生命活动中行使着重要的角色,发挥着不可或缺的作用。这引起业内对蛋白质拓扑结构调控的广泛兴趣。近年来,发展拓扑蛋白质的制备方法,并探究其结构性能关系和相关应用,已经成为蛋白质工程的热门方向。北京大学张文彬课题组近期在拓扑蛋白质的合成和表征方面取得重要进展。他们通过模拟天然拓扑蛋白质合成中的多步翻译后修饰过程,基于合理的基因序列设计,结合原位组装、链断裂和正交的定点环化反应,发展了一种高效的蛋白质异质索烃的生物合成方法,不需要额外的胞外反应过程,通过直接表达、纯化即可制备蛋白质异质索烃。该方法主要利用p53dim结构域(X)的分子内二聚来引导同一基因片段中两种目标蛋白质之间的异质二聚,通过共表达蛋白酶进行原位酶切断链,同时利用可基因编码的蛋白质定点偶联反应来实现环化合成蛋白质异质索烃。例如,他们利用谍标签(A)-谍捕手(B)反应对来实现侧链偶联环化,通过原位酶切激活分离型内含肽(IntC1/IntN1)介导的主链偶联环化反应,构建了具有支化结构的蛋白质异质索烃,并容许通过基因工程的手段模块化地融合各种目标蛋白质(图1)。
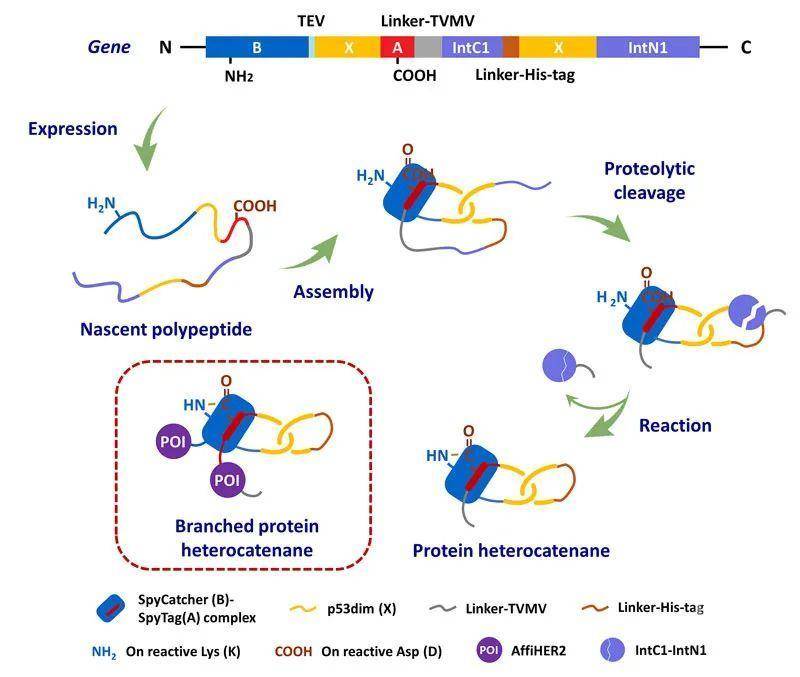
为进一步简化合成过程,他们基于分离型内含肽在反应时会自身从主链上切除下来的特性,设计了由两种正交的分离型内含肽介导的环化过程,其可以在胞内次序发生反式剪接和自发链断裂,从而消除了原位酶切反应的必要性,并可实现两个蛋白质结构域的主链环化,制备结构更加简洁的蛋白质异质索烃(图2)。X射线单晶衍射实验成功解析了利用该方法制备的cat-GFPX-X的晶体结构,有力地证明了其中两个环状组分之间机械互锁的空间关系(图3)。这也是第一个人工设计合成的蛋白质异质索烃的晶体结构。
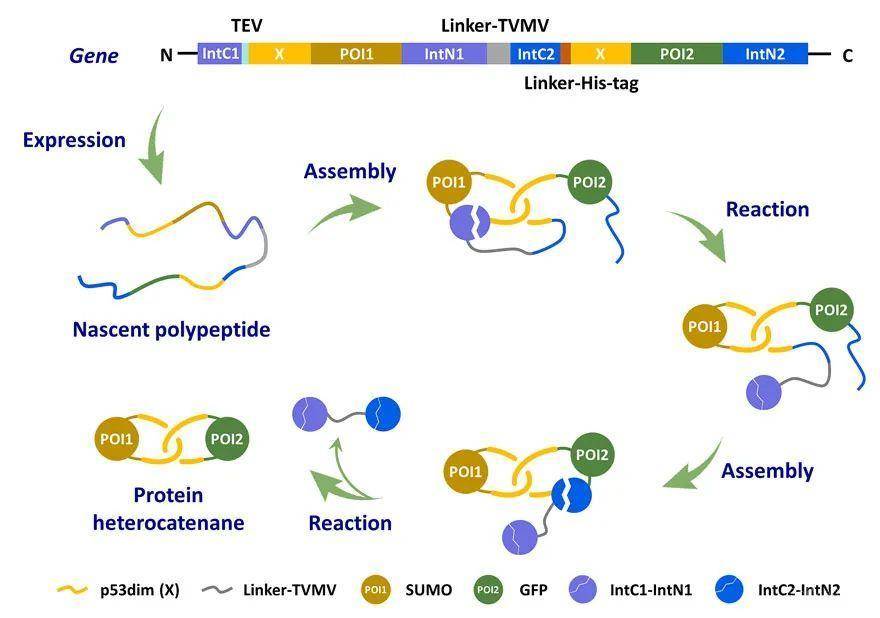
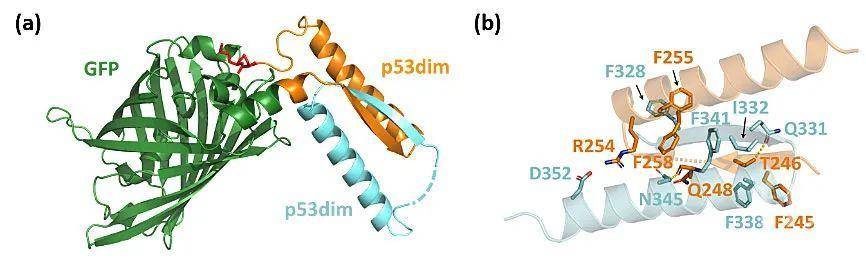
该方法的优势在于其可基因编码,高度模块化,且合成过程无需额外控制,在细胞内直接自发完成,既大大简化了合成步骤,又有效提高了产物的纯度。它适用于胞内合成含有多种功能蛋白质的异质索烃,并可拓展到各种具有支化结构的异质索烃。相较于同质索烃,它们的分子结构复杂性和多样性进一步提高,有望更好地实现不同结构域之间的协同,深入地探讨拓扑结构对分子性质和功能的影响,在工业酶工程和生物医药领域具有广泛的潜在应用价值。
该研究近期在线发表于Angew. Chem. Int. Ed.,北京大学化学与分子工程学院博士生刘雅杰、方晶和生命科学学院博士生段泽林为该论文共同第一作者。北京大学化学与分子工程学院博士生张凡也为本工作做出了贡献。北京大学化学与分子工程学院张文彬教授和生命科学学院肖俊宇研究员为共同通讯作者。该工作得到国家自然科学基金、科技部、北京分子科学国家研究中心创新项目和北京大学临床医学+X青年专项项目的支持。
来源:X-molNews X一MOL资讯
原文链接:http://mp.weixin.qq.com/s?__biz=MzAwOTExNzg4Nw==&mid=2657642189&idx=3&sn=88b31d16a200d4ffa97f98e198c3465c&chksm=80f84f1db78fc60b9a080cc61e858528058d23f8449c17c576bf4ca64948bc2c88a88ef16732&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn


