来源:BioArt
口服给药是最常见的给药途径之一,通过该给药途径,药物会在肠道中被吸收,然后进入体循环发挥作用。
然而,近年来越来越多的研究发现肠道中的微生物会与药物发生直接或间接的相互作用,包括微生物衍生酶将药物转化为其他活性代谢产物(后文称该过程为Microbiome-Derived Metabolism, MDM)、微生物代谢产物与药物竞争同一宿主酶、药物分泌的非活性代谢产物被微生物再活化等作用【1-6】。
虽然人们已经意识到MDM对药代动力学的重要影响,但是由于微生物组的复杂性,以及在多种条件下测试数百种药物和数千种代谢产物的巨大技术挑战,导致目前缺乏关于MDM的系统性研究。
此外,由于菌株单独培养和与其他微生物共培养会表现出明显的基因表达差异,因此需要开发一种能够更好地反映体内菌群状态并适于MDM研究的体外混合培养系统。
2020年6月10日,美国普利斯顿大学Mohamed S. Donia团队在Cell杂志上发表的题为Personalized Mapping of Drug Metabolism by the Human Gut Microbiome的研究论文为这一问题提供了解决方案。该研究为我们提供了一套定量实验方案——MDM-Screen,以评估肠道菌群代谢口服给药药物的能力。

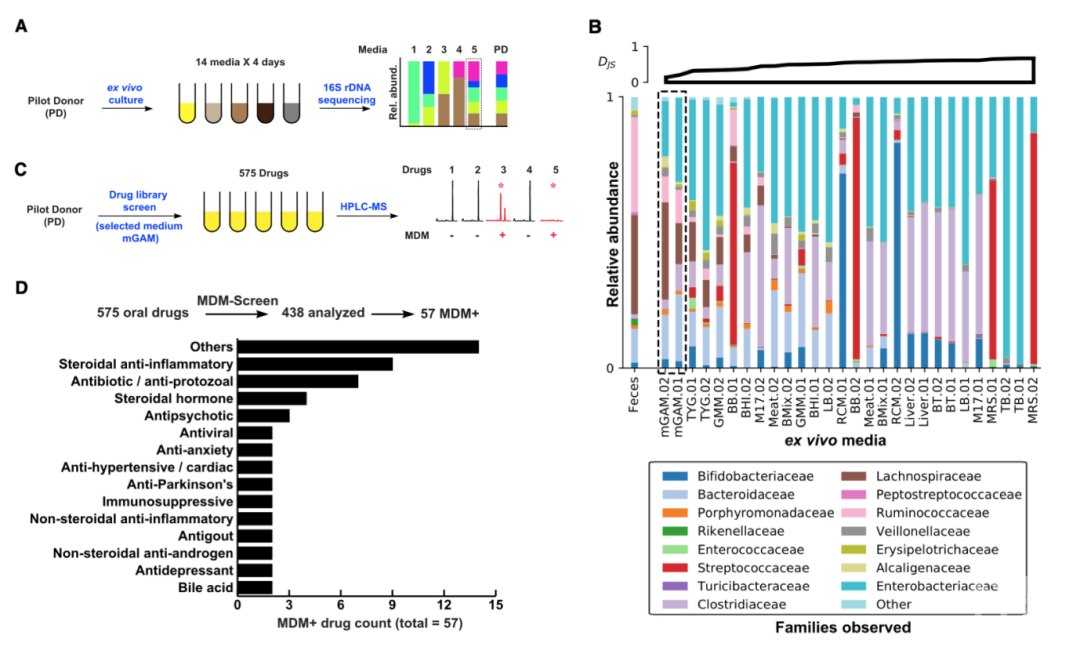
该研究团队首先针对一名志愿者(PD)的肠道菌群展开了研究,以建立初步的实验方案。研究人员利用14种不同的培养基对PD的粪便样本进行了体外培养,并利用16S rRNA测序技术将培养结果与粪便样本进行比较,结果显示mGAM培养基与粪便样本的测序结果相似性最高,且该培养基的重复性较好。
进一步,研究人员基于mGAM培养基,将微生物样本分别与575种口服药物在37 摄氏度下共培养,然后使用HPLC-MS方法对代谢产物进行鉴定,以筛选探究会发生MDM的药物。同时设置了2个对照组:(1)肠道菌群与DMSO共培养;(2)无菌mGAM与药物共培养。
如果药物的培养结果满足以下条件则被认为是阳性结果(MDM+):
(1) 培养液中坚鉴定获得新的代谢产物或者培养液中无法鉴定到原药物(2) 3次独立重复试验中至少有2次得到一致性的结果
通过上述实验方案,研究人员成功分析了438种药物的代谢情况,其中57种药物为MDM+,涉及28个药物类别。57种药物中的45种为新被发现的MDM+,具体包括10个培养后原药物不存在的药物和35个产生新代谢产物的药物。
为进一步扩大MDM筛选的范围,以对更多个体的肠道菌群代谢药物的情况进行研究,研究人员对实验方案进行了改良。
为确定适用于更多个体的最佳培养基,该团队建立了一个能够更好地评估丰富度的指标Expected Number of Detectable Strains (ENDS),该指标考虑了微生物代谢产物可被检测的概率和生物量。通过该指标,该团队获得了一种全新的最佳培养基:70%的BB培养基+30%的mGAM培养基(被称为“BG”培养基)。
同时,该团队采用96孔板替代普通试管进行下游的代谢组分析鉴定MDM+药物。
通过上述方法该研究团队对20名志愿者的样本和23种药物进行分析,结果显示该方法能够有效鉴定出个体间的MDM差异。
为进一步评估该方法的可靠性和实用性,团队进一步挖掘了参与药物代谢的微生物衍生酶。研究人员以治疗乳腺癌、大肠癌、胃癌的化学疗法药物卡培他滨(capecitabine)等药物为例进行了相关研究。
在MDM-Screen的研究中,研究人员发现卡培他滨会发生去糖基化。而过去的研究已经报道人体中的胸苷磷酸化酶 (TP) 和尿苷磷酸化酶 (UP) 会参与这一过程,但是微生物组中是否存在类似的作用尚未有研究。
因此,研究人员基于同源性鉴定了相关的微生物同源基因,并构建了TP (ΔdeoA)、 UP (Δudp)以及双敲除的E.coli BW25113菌株。结果显示,野生型E.coli能够有效对卡培他滨进行去糖基化,而Δudp 和Δ deoA/ Δudp菌株的去糖基化效果明显下降。
类似的结果还出现在与卡培他滨同为口服氟嘧啶类(FP)的药物去氧氟尿苷(doxifluridine)和三氟尿苷(trifluridine)。上述结果为FP在不同病人间药效不同提供了新解释。
此外,研究人员还利用小鼠模型进一步验证了微生物对卡培他滨的去糖基化作用在体内也能够发生。
图2.基于正交策略的微生物衍生酶鉴定
由于基于同源性的鉴定方法使用范围较为局限,因此研究人员还利用正交策略进行了微生物衍生酶的鉴定。通过构建不同E.coli表达载体进行功能筛选,最终成功鉴定得到能够将氢羟肾上腺皮质素(hydrocortisone)转化为20b-dihydrocortisone的微生物衍生酶。
上述结果表明将MDM-Screen与功能宏基因组方法相结合是一种有效的策略,可以建立MDM-Screen结果与来自不同细菌的代谢酶之间的联系,而不需要进行细菌分离。
综上,该研究为我们提供了一种能够有效探究肠道菌群代谢药物的定量实验方案,为药物微生物组学的研究提供了新手段。
但是该研究仍存在一些限制:首先,在最初的575种药物中仍有24%的被测药物无法被分析;其次该研究仅关注了口服药物,一些非肠道药物可能也会发生MDM;此外,该研究依然无法100%复原肠道菌群,即支持原始样品中全部的微生物生长。
原文链接: https://doi.org/10.1016/j.cell.2020.05.001
来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652487795&idx=3&sn=d7664009723fddd69c9a665efab1feb4&chksm=84e253c7b395dad1098d687aa8bea7f59cb7f13b504c1b3a3258854943fc2195b1188250a57a#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



