来源:BioArt
低密度脂蛋白受体和正常细胞脂质代谢信号通路的科学发现,获得了1985年诺贝尔生理学/医学奖。正常细胞的脂质合成代谢受到负反馈调节:当细胞内的脂质浓度正常时,与脂质结合的内质网跨膜蛋白INSIG1/2会与调控脂合成的关键转录因子SREBP及其护送蛋白SCAP相互作用,会使该复合体锚定于内质网,进而阻止SREBP的激活并抑制细胞的脂质合成;相反,当细胞中脂质含量较低时,脱离脂质结合的INSIG1/2不再与SCAP-SREBP相互作用并导致SREBP从内质网转移至高尔基体。在分别被高尔基体上的蛋白酶S1P和S2P剪切后,SREBP前体蛋白的N端部分被释放,并转运至细胞核激活脂质合成代谢相关基因的转录。
但是,对于肿瘤细胞而言,即使细胞内的脂质浓度是正常的,SREBP仍然始终处于激活状态以促进肿瘤的快速增殖。因此,肿瘤细胞有别于正常细胞脂质代谢的分子机制是肿瘤研究领域的核心问题之一。
2020年4月8日,由浙江大学、青岛大学、中国台湾地区中国医药大学以及美国MD安德森癌症中心合作,吕志民团队联合洪明奇团队在Nature杂志上在线发表了题为The gluconeogenic enzyme PCK1 phosphorylates INSIG1/2 for lipogenesis的研究论文,揭示了肿瘤细胞特异性脂质合成代谢机制。

磷酸烯醇丙酮酸羧化激酶1(PCK1)是糖异生的限速酶,它可以将草酰乙酸(OAA)转变为磷酸烯醇式丙酮酸(PEP)和二氧化碳。作为糖酵解的逆反应,糖异生在大多数肿瘤中受到抑制,然而糖异生中的代谢酶在肿瘤发生发展中发挥的作用仍不清楚。PCK1发挥糖异生代谢酶活性的场所是细胞质,本研究发现肿瘤细胞中一部分PCK1由细胞质转移至内质网。在酪氨酸激酶受体(RTK)或KRAS激活的肿瘤细胞中,AKT磷酸化PCK1的90位丝氨酸,从而导致PCK1发生内质网易位并使其失去了原本的糖异生代谢酶功能。取而代之的是,PCK1获得了蛋白激酶功能,以GTP作为磷酸基供体磷酸化INSIG1/2使其与细胞内脂质的结合出现障碍,进而促进SREBP信号通路的激活及肿瘤细胞的脂质合成。动物实验和肝癌临床样本分析揭示PCK1-INSIG1/2-SREBP信号通路不仅促进了肝癌的发生发展,而且与肝癌患者预后和生存期密切相关。
该研究的重要性主要体现在:(1) 阐明了肿瘤细胞脂质感应异常及脂质合成持续激活的重要机制;(2) 首次发现了糖异生代谢酶PCK1具有蛋白激酶活性;(3)揭示了PCK1以GTP作为磷酸基供体对蛋白底物进行磷酸化,这有别于普遍的以ATP作为磷酸基供体的蛋白激酶;(4)论述了PCK1的内质网易位是肿瘤细胞协同调节糖异生降低和脂质合成激活的重要分子机制。
肿瘤的大量基因突变及特有的微环境,往往导致代谢酶原有的功能改变并赋予其新的非代谢酶功能。继发现糖代谢酶PKM2、PGK1、KHK-A的非代谢酶活性在肿瘤发生中重要作用之后,该研究是吕志民团队发现的第四个具有蛋白激酶活性的代谢酶。该研究不仅为癌症的个体化治疗揭示了新的代谢标记物和分子靶点,而且对靶向肿瘤脂代谢的药物研发具有重大的指导意义。
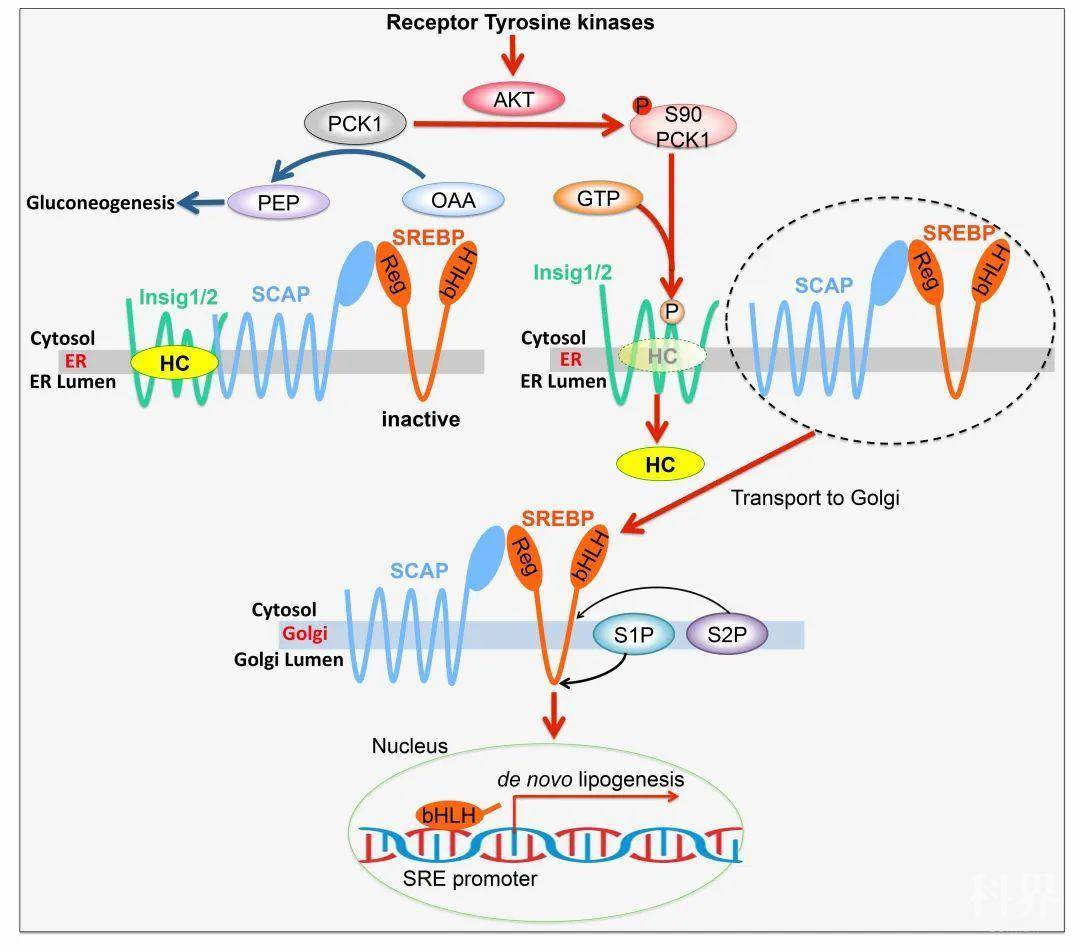 PCK1介导的Insig1/2磷酸化促进脂质合成和肿瘤发生的分子机制(注:HC:羟基胆固醇;OAA:草酰乙酸; PEP:磷酸烯醇式丙酮酸;bHLH:SREBP的碱性螺旋-环-螺旋结构域; Reg:SREBP的调节亚基;ER:内质网;Golgi:高尔基体;)
PCK1介导的Insig1/2磷酸化促进脂质合成和肿瘤发生的分子机制(注:HC:羟基胆固醇;OAA:草酰乙酸; PEP:磷酸烯醇式丙酮酸;bHLH:SREBP的碱性螺旋-环-螺旋结构域; Reg:SREBP的调节亚基;ER:内质网;Golgi:高尔基体;)原文链接:
https://doi.org/10.1038/s41586-020-2183-2
https://doi.org/10.1038/s41586-020-2183-2
来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652483148&idx=4&sn=6476169910ea1287f775ee7547c2705b&chksm=84e23df8b395b4ee0e5f6154c2a19b7a71ba9274a56580c3df84fbc3de176ee70576d169d821#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn


