来源:Deep Omics
文章题目:Clonal replacement of tumor-specific T cells following PD-1 blockade
发表时间:2019年7月29日
期刊名称:Nature Medicine
PMID: 31359002
关键词:单细胞RNA和TCR测序,T细胞,克隆替换,PD-1免疫治疗

虽然免疫检查点抑制剂疗法已让很多癌症患者获益,但我们还不清楚T细胞对检查点阻断的反应,是依赖于原先存在的肿瘤浸润淋巴细胞的再激活,还是新募集的T细胞。研究人员对来自PD-1治疗前后基底或鳞状细胞癌患者的79,046个细胞进行了单细胞RNA和TCR测序。追踪TCR克隆和转录表型揭示了肿瘤识别、克隆扩增和T细胞功能障碍的关联。T细胞克隆的扩增并非来源于已存在的肿瘤浸润性T淋巴细胞,而是由新进入肿瘤的T细胞组成。
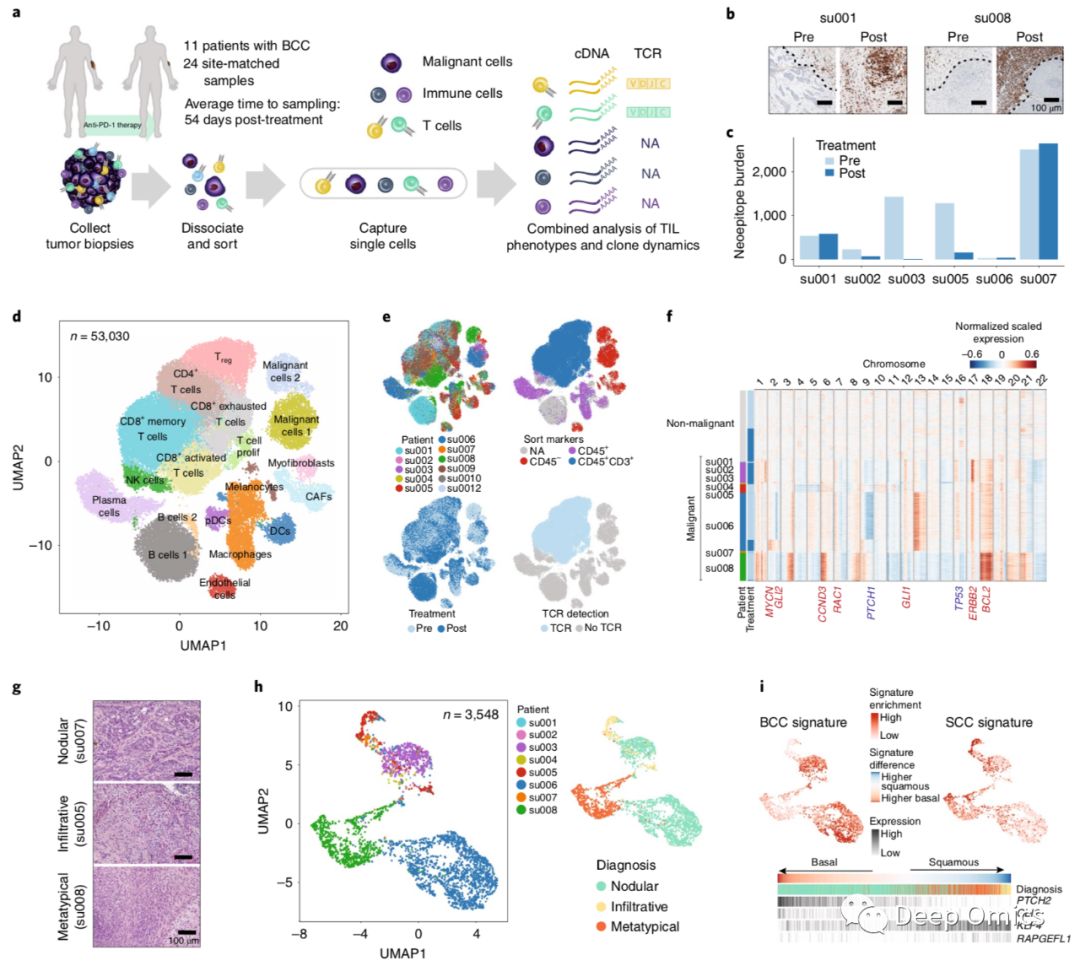
图1 基于单细胞RNA-seq描绘抗PD-1阻断治疗前后BCC免疫微环境
对11位接受PD-1免疫治疗基底细胞癌(BCC)患者的治疗前后样品进行单细胞RNA-seq、TCR-seq、全外显子组测序和CD3免疫组化(图1a),发现治疗后肿瘤的CD3+ T细胞浸润增加(图1b)和突变数量减少(新抗原数量变化)----肿瘤免疫编辑(图1c)。
肿瘤微环境里免疫细胞类型一致
首先,对53,030个细胞的scRNA-seq数据进行聚类分析,得到19个细胞簇(包括两个肿瘤细胞簇,六个T细胞簇,四个基质簇,三个骨髓簇,三个B细胞簇和一个自然杀伤细胞簇),免疫细胞分类与细胞分离实验使用的表面标志物一致(图1e)。值得注意的是,来自不同患者的免疫细胞聚集在一起,表明不同患者肿瘤微环境(TME)里免疫细胞类型的一致性。单细胞水平的拷贝数变异(CNV)揭示了患者特异性CNV仅在恶性肿瘤细胞中出现(图1f)。然后对3548个恶性肿瘤细胞的scRNA-seq数据进行聚类,发现来自不同患者的BCC细胞明显分开(图1g、h),存在明显的肿瘤间异质性。用bulk RNA-seq数据对恶性细胞的表达特征进行打分,揭示了结节性BCC中基底特征的富集,浸润性和异型BCC中鳞状特征的富集(图1i)。总之,BCC里基因表达受到患者特异性肿瘤通路影响,但不会影响TME里免疫细胞类型。
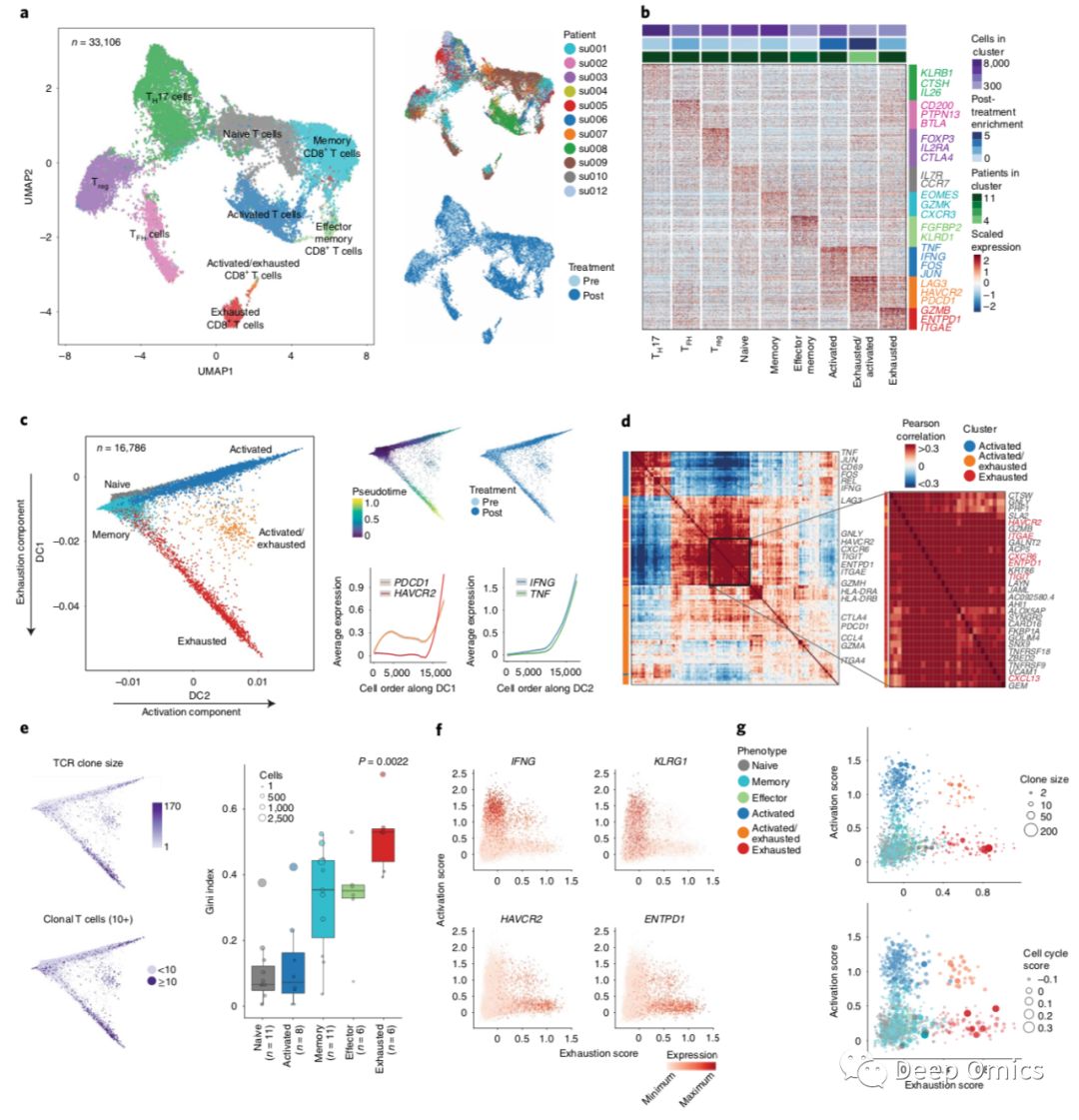
图2 耗竭CD8+ 肿瘤浸润T细胞克隆扩增并表达肿瘤特异性标志物
在PD-1阻断后耗竭CD8+ TIL增加
接下来,研究人员将重点放在肿瘤浸润淋巴细胞(TILs)上,以了解克隆性T细胞对检查点阻断的反应。
对33,106个肿瘤浸润淋巴细胞的scRNA-seq数据进行聚类,其中28,371个T细胞进行了TCR-seq测序(86%;图1d,e)。鉴定了9个不同的T细胞簇,这些细胞来自多个患者治疗前后不同时间节点(图2a,b)。CD4+簇包括调节性T细胞(Treg)细胞、滤泡辅助性T(TFH)细胞和T辅助细胞17(TH17)细胞;CD8+簇包括初始细胞、记忆细胞、效应记忆细胞、活化细胞、慢性活化/耗竭细胞(以下称为耗竭细胞)和中间耗竭/活化细胞(共表达激活和衰竭相关基因)。值得注意的是,作者观察到治疗后样品中TFH、活化、耗竭和耗竭/活化的CD8+ T细胞频率明显增加,这与之前报道的结论相符----PD-1阻断主要影响CD8+ T细胞(图2b)。
使用扩散图来可视化拟时间分析得到的CD8+ T细胞簇和有序细胞之间的关系(图2c)。第一个扩散成分将活化细胞和耗竭细胞分开,并与T细胞耗竭基因高度相关,包括PDCD1和HAVCR2;而第二个扩散成分从活化和耗竭的细胞中分离出初始细胞和记忆细胞,并与T细胞活化基因高度相关,包括IFNG和TNF(图2c)。使用共表达分析来识别检查点阻滞背景下的核心T细胞衰竭特征,其中包括已知的耗竭标记物(HAVCR2,TIGIT)、组织驻留记忆T细胞(TRM)标记物(ITGAE,CXCR6)、肿瘤反应性CD8+ TIL的标志物,如CD39(由ENTPD1编码)(图2d)。这些结果表明,在PD-1阻断后,耗竭CD8+ TIL增加,并表达慢性激活、T细胞功能障碍和肿瘤反应性的基因特征。
由于肿瘤抗原特异性CD8+ T细胞在高效的免疫反应中发生克隆扩增,研究人员分析了单细胞TCR测序数据,以鉴定克隆扩增的细胞作为肿瘤特异性指标。通过TRA(其编码TCRα)和TRB(编码TCRβ)序列对细胞进行分组,在耗竭T细胞中观察到更大的克隆大小(图2e)。使用基尼指数测量克隆性,观察到耗竭T细胞的克隆性明显比其他CD8+ T细胞更高(图2e)。对CD4+ T细胞的分析显示治疗后TFH细胞的克隆性增加,其中一名患者伴随着B细胞的增加。
为了探究克隆扩增和耗竭之间的联系,研究人员分别基于与IFNG和HAVCR2表达相关的前50个基因对所有CD8+细胞的激活和耗竭特征进行评分(图2f)。发现具有高耗竭特征的T细胞表现出与肿瘤反应性相关的基因表达模式,包括CD39(由ENTPD1编码)和CD103(由ITGAE编码)表达,以及缺乏KLRG1(衰老标志物)表达。为了表征单个克隆,作者对每个克隆中所有细胞的耗竭和激活打分取均值,并在最大的克隆中观察到高耗竭基因特征(图2g)。耗竭克隆也表现出高增殖特征(图2g)。
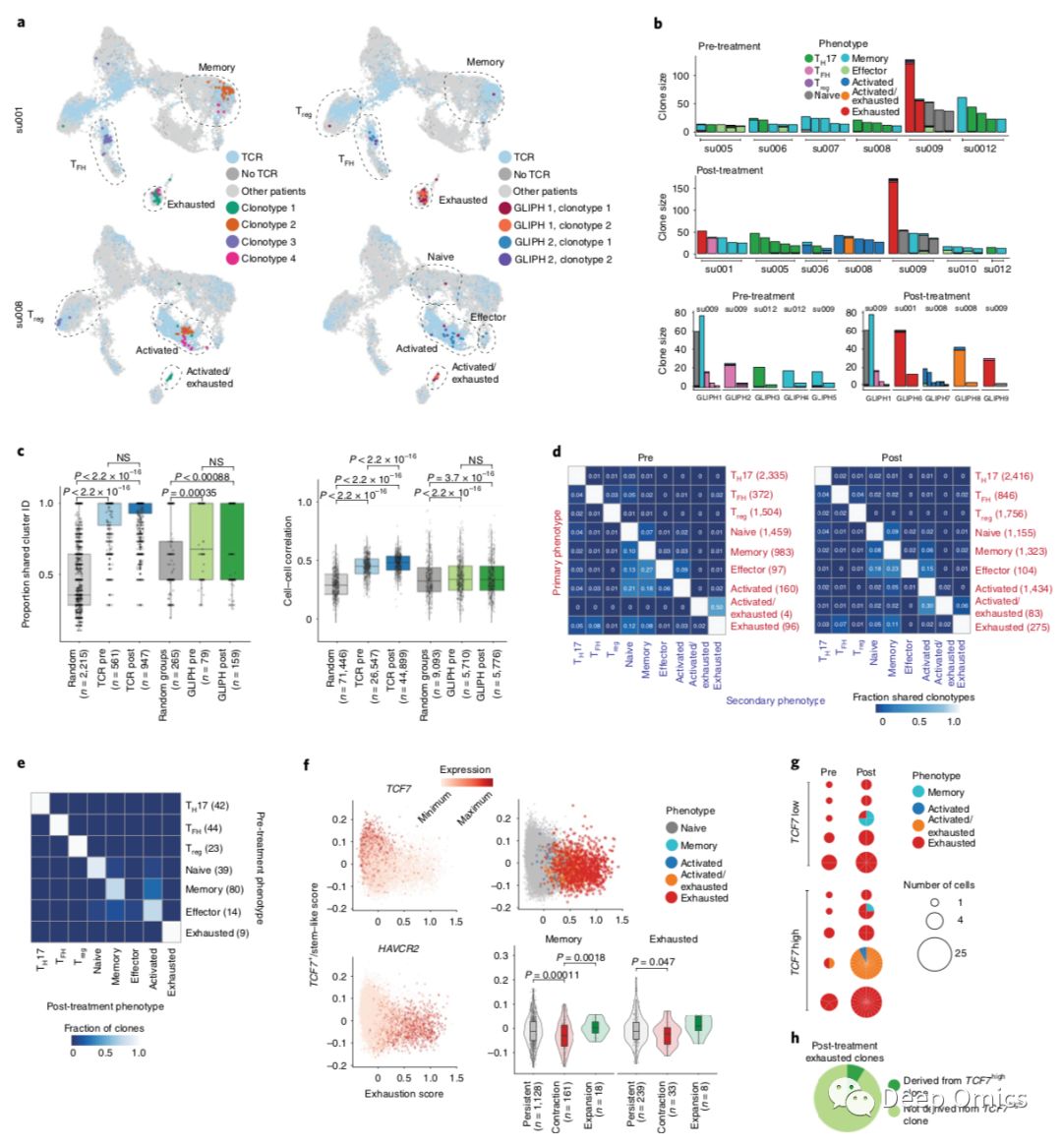
图3 肿瘤浸润性T细胞克隆动态和表型转换
接下来分析了T细胞表型和TCR克隆型之间的谱系关系。总的来说,作者发现通过克隆型分组的细胞更可能具有共同的表型,并且基因表达的相关性比随机分组的细胞更高,与先前的研究一致(图3a-c)。然后作者研究了克隆中的不同表型是否可以反映T细胞表型之间的谱系转换。聚合了主要表型中的所有克隆型并测量了与次级表型共享的部分(图3d)。研究人员发现到CD8+ T细胞表型(包括记忆和活化的T细胞)之间存在明显重叠,这表明激活状态之间存在共同的转变。在耗尽细胞和效应细胞之间检测到最小的克隆型共享,意味着这些表型之间严格的分界。 CD4+ T细胞克隆主要限于单一表型,表明CD4 +细胞状态之间存在有限的可塑性。
为了追踪PD-1阻断后克隆细胞的命运,研究人员基于TRB序列比较了所有克隆在不同治疗时间点的主要表型(图3e),观察到CD4+簇之间的稳定性以及CD8+簇之间的频繁转换。虽然观察到记忆和效应与活化状态之间的频繁转换,但治疗前的耗竭克隆并未在治疗后转变为非耗竭型,这表明耗竭TILs在PD-1阻断后发生表型转变的能力有限。
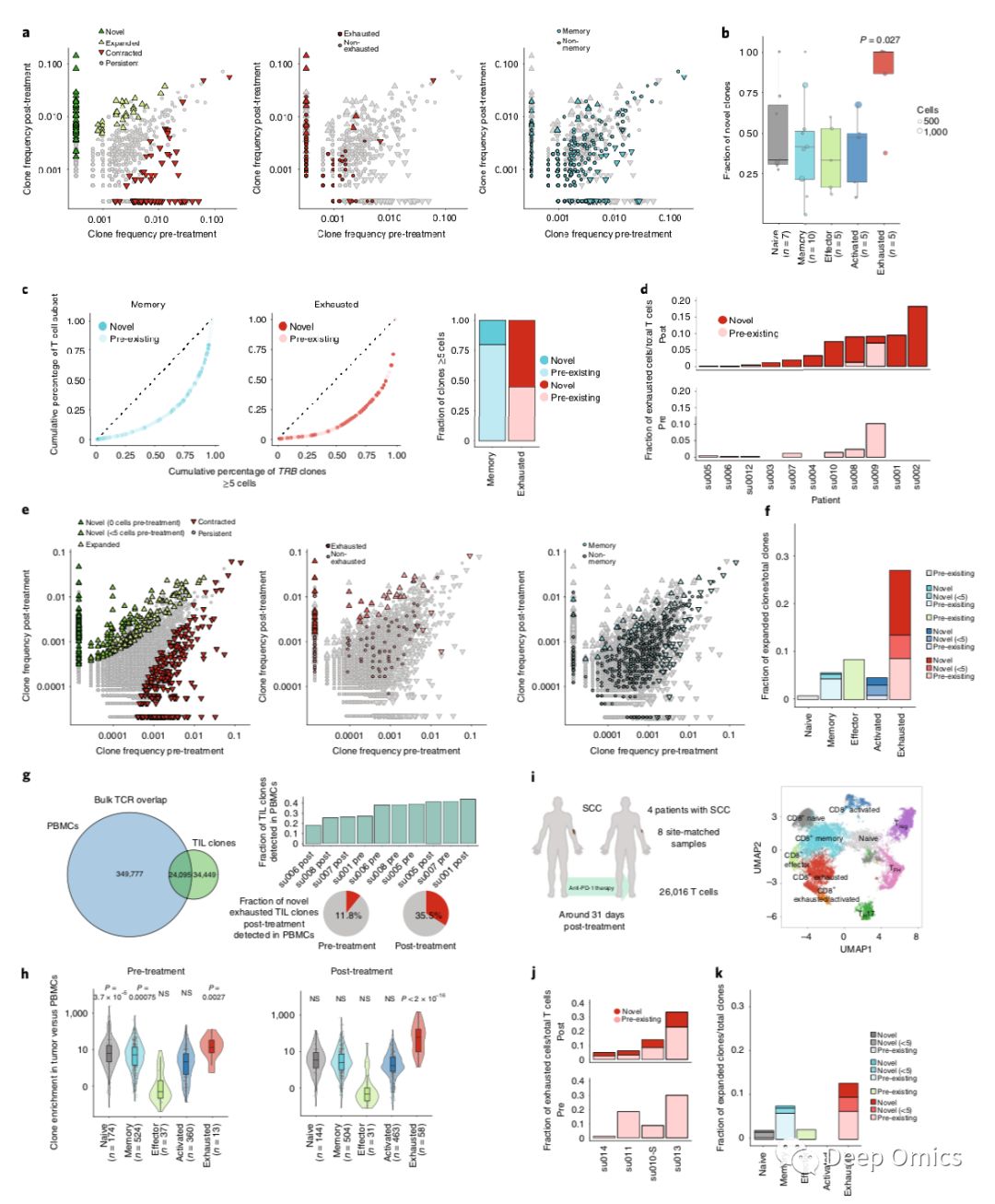
图4 PD-1阻断后耗竭CD8+ T细胞的克隆替换
由于很少有原先存在的耗竭T细胞在治疗后显示出扩增,研究人员比较了每个克隆的治疗前和治疗后频率来研究克隆丰度如何随着治疗发生改变(图4a)。在治疗后发现了显著扩增的克隆,其中许多在治疗前未检测到(68%的显著扩增的克隆)。平均来说,84%的耗竭克隆来自患者新的克隆型(图4a,b)。接下来作者想知道新克隆扩增(即克隆替换)如何影响每个患者的耗竭T细胞频率(图4d)。发现11名患者中有7名患者在治疗后耗竭CD8+ T细胞频率增加,且其中有6名患者的大多数耗竭CD8+ T细胞来自新型克隆型(图4d)。
为了提高罕见克隆型的检测灵敏度,作者对8名患者的剩余活检样品进行了bulk TCR-seq(图4e)。与单细胞TCR-seq分析类似,观察到大量新的扩增克隆,既未在治疗前检测到,又未在治疗前扩增。与所有其他CD8+表型相比,耗竭细胞在治疗后具有明显更高比例的扩增克隆,并且大多数扩增的克隆来自新的克隆型,这与在治疗后发生耗尽细胞扩张的患者中观察到的一致(图4f)。
为了排除克隆替换现象是否由采样偏差引起的,作者对患者治疗前的肿瘤样本进行了两次bulk TCR-seq,并且以大约两个月为间隔在治疗后又进行了两次测序,仅在治疗前和治疗后样本的比较中观察到耗竭克隆的克隆替换,表明耗竭T细胞的TCR动态主要受PD-1阻断的影响,而不是肿瘤活检的时间或位置。
为了确定能否在外周血中检测到新的克隆扩增的TIL(肿瘤浸润淋巴细胞),作者对5名患者的10个外周血样品进行了bulk TCR-seq。41%的TIL TRB克隆型也可在血液中检测到,但它们仅代表血液克隆型多样性的6%(图4g),血液克隆型代表所有TIL表型,包括新的耗竭TIL。在治疗后外周血中检测到35.5%的新的TIL克隆型, 11.8%的新的TIL克隆型在治疗前的外周血里检测到,尽管在治疗前肿瘤细胞的TCR-seq检测不到(图4g)。这些结果表明,从血液里监测肿瘤特异性T细胞对检查点阻断的反应是可行的,新的TIL克隆可以从外周血募集。
最后,研究人员探究是否可以在不同的癌症类型中观察到耗竭细胞的克隆替代。对26,016个TIL进行scRNA-seq和scTCR-seq测序,这些TIL来自于接受抗PD-1治疗的4名SCC患者(图4i)。为了能够在治疗后尽早地分析TIL动态,作者在治疗后31天左右进行取样。治疗后样品中检测到的相当大比例的耗尽细胞来自新的克隆型(图4j)。50%扩增的耗竭克隆来源于新的克隆型(图4k)。
总之,本研究表明,与免疫沙漠(即免疫“冷”)肿瘤相比,免疫浸润(即免疫“热”)肿瘤的检查点阻断活性得到改善,可能是由于不断吸引新T细胞的能力所致,而不是重新激活已有的TIL。
我们的思考
既然对免疫疗法起作用的是新招募的T细胞,而不依赖于已有的肿瘤浸润性淋巴细胞,如何帮助免疫细胞进入实体瘤组织是实现免疫治疗的关键一环。目前有研究团队尝试借助病毒感染重新激活“免疫沙漠”肿瘤的免疫微环境,将其转化为免疫浸润性肿瘤。直接注射肿瘤疫苗(肿瘤特异性抗原),激活T细胞识别肿瘤也可以帮助招募更多的免疫细胞进入肿瘤,故结合肿瘤疫苗和免疫检查点抑制剂的免疫疗法可以惠及更多的肿瘤患者。
来源:gh_cc101106ed81 Deep Omics
原文链接:http://mp.weixin.qq.com/s?__biz=MzI2NDg2MjgyOA==&mid=2247483735&idx=1&sn=ea50464727ddc125b87f297008e0cb06&chksm=eaa76c54ddd0e5421cda79ce2e0db31a8ccbbbbcfdd3aa66bea53bedfbc45063eb98415c4b5c&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



