来源:BioArt
不孕不育是世界范围共同面对的严峻生殖健康问题。我国育龄人口中不孕不育发生率已高达10%~15%。遗传因素是不孕不育的一大主因,尤其在男性中,由遗传因素(基因突变)导致的精子发生障碍约占75%。包括我们人类在内的哺乳动物都是由生殖细胞精子和卵子受精后发育而成的。减数分裂是生殖细胞形成过程中特有的一种细胞分裂方式,也是一个极其复杂的过程。减数分裂分为减数分裂I和减数分裂II,其中减数分裂I的前期对于正常配子的形成至关重要。减数分裂I前期分为细线期,偶线期,粗线期,双线期。减数分裂I前期向中期的转变过程中,染色体经历解联会,进一步的染色体凝聚和压缩。大量研究表明蛋白磷酸化抑制剂冈田酸(okadaic acid)可以诱导减数分裂粗线期向中期的转变,这意味着减数分裂期染色体在粗线期时就已获得向中期转变的能力。
针对这一关键的减数分裂时期转换已经有了大量的研究,但是减数分裂I前期是如何获得向中期转换能力的分子机制仍然不清楚。
2020年3月25日,美国宾夕法尼亚大学Jeremy Wang教授和武汉大学罗孟成教授合作(宾夕法尼亚大学博士后关永娟为第一作者)在Science Advances杂志上发表了文章“SKP1 drives the prophase I to metaphase I transition during male meiosis”。该论文揭示了SKP1 调控减数分裂I前期向中期转变的分子机制, 为治疗男性不孕不育提供理论依据。

SKP1是SKP1–Cullin–F-box (SCF) E3 ligase复合体的重要组成部分。该团队发现SKP1位于减数分裂染色体联会区域,当该团队利用生殖细胞特异性Ddx4 cre 将SKP1敲除时发现雄性小鼠和雌性小鼠都不育。雄性敲除小鼠睾丸中所有生殖细胞消失,只有支持细胞存在。雌性敲除小鼠卵泡数目减少,到四月龄彻底消失。而且该团队发现SKP1缺失会导致卵母细胞粗线期染色体提前解离。
2020年3月25日,美国宾夕法尼亚大学Jeremy Wang教授和武汉大学罗孟成教授合作(宾夕法尼亚大学博士后关永娟为第一作者)在Science Advances杂志上发表了文章“SKP1 drives the prophase I to metaphase I transition during male meiosis”。该论文揭示了SKP1 调控减数分裂I前期向中期转变的分子机制, 为治疗男性不孕不育提供理论依据。

SKP1是SKP1–Cullin–F-box (SCF) E3 ligase复合体的重要组成部分。该团队发现SKP1位于减数分裂染色体联会区域,当该团队利用生殖细胞特异性Ddx4 cre 将SKP1敲除时发现雄性小鼠和雌性小鼠都不育。雄性敲除小鼠睾丸中所有生殖细胞消失,只有支持细胞存在。雌性敲除小鼠卵泡数目减少,到四月龄彻底消失。而且该团队发现SKP1缺失会导致卵母细胞粗线期染色体提前解离。
为了进一步研究SKP1在雄性生殖细胞中的作用,该团队采用泰莫西芬诱导的方式敲除生殖细胞中的SKP1,敲除后雄性小鼠睾丸内出现大量双线期细胞。这表明与卵母细胞一致,在精母细胞里,SKP1缺失同样会导致粗线期染色体提前解离,这是目前唯一一个具有联会复合体提前解离表型的小鼠研究报道。
令该团队兴奋的是泰莫西芬诱导敲除的雄性生殖细胞里虽然有大量双线期细胞富集,但是却没有中期细胞,这表明SKP1是减数分裂I前期到中期转换的关键因子。为了验证这个观点,该团队选用多种中期标记蛋白,发现这些蛋白在SKP1敲除的小鼠睾丸里均消失。SKP1敲除后,即使用冈田酸处理,粗线期染色体也无法进入中期,这表明SKP1确实是减数分裂染色体获得进入中期能力所必须的一个调控因子。
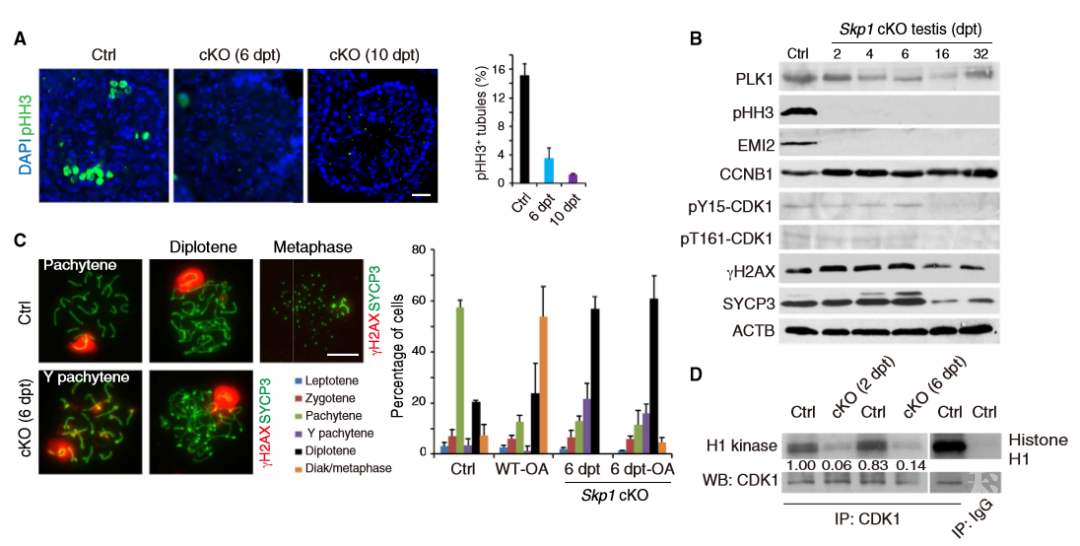 图1. SKP1是保持MPF活性和促进减数分裂I前期到中期转化的关键因子
图1. SKP1是保持MPF活性和促进减数分裂I前期到中期转化的关键因子
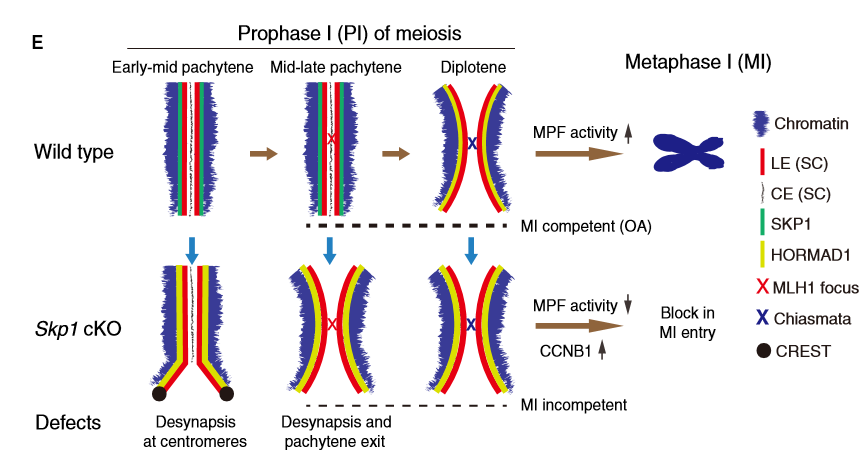
SKP1敲除小鼠模型是目前唯一一个具有提前解联会表型的小鼠模型,该模型可以有效的帮助大家研究粗线期到双线期的变化机理。该论文从多个角度揭示了SKP1 在维持减数分裂联会和调控减数分裂I前期到中期的分子机制,为进一步研究减数分裂I前期到中期的转变提供重要依据。
该论文第一作者关永娟于2011年毕业于西北农林科技大学获得动物医学学士学位,于2015年毕业于澳大利亚西澳大学获得博士学位,博士期间致力于雄性动物生殖学研究,博士期间以第一作者发表SCI论文5篇。博士毕业后加入宾夕法尼亚大学Jeremy Wang团队进行博士后训练,博士后期间主要从事减数分裂, piRNA通路以及转座子的研究。
该论文共同通讯作者罗孟成于2005年本科毕业于武汉大学生命科学学院,2010年博士毕业于武汉大学病毒学国家重点实验室,随后加入宾夕法尼亚大学Jeremy Wang课题组进行博士后训练。2016年入选中组部青年千人计划后回国入职武汉大学基础医学院,为人体解剖与组织胚胎学系教授,独立PI。罗孟成教授实验室专注男性不育的减数分裂调控机制研究,期望通过对减数分裂同源重组机制的系统研究为不孕不育诊治和体外生殖体系的建立提供理论依据。
该论文共同通讯作者Jeremy Wang教授自2002年加入宾夕法尼亚大学后一直致力于减数分裂和piRNA通路研究,该实验室做出的多种敲除小鼠对于生殖领域的进展贡献卓著,该实验室目前已发表高水平论文50余篇。由于Jeremy Wang教授在基础生殖研究领域的突出贡献,他荣获了在生殖领域享有盛誉的SSR (Society for the Study of Reproduction) 2020研究型奖章。
 图1. SKP1是保持MPF活性和促进减数分裂I前期到中期转化的关键因子
图1. SKP1是保持MPF活性和促进减数分裂I前期到中期转化的关键因子SKP1敲除小鼠模型是目前唯一一个具有提前解联会表型的小鼠模型,该模型可以有效的帮助大家研究粗线期到双线期的变化机理。该论文从多个角度揭示了SKP1 在维持减数分裂联会和调控减数分裂I前期到中期的分子机制,为进一步研究减数分裂I前期到中期的转变提供重要依据。

该论文第一作者关永娟于2011年毕业于西北农林科技大学获得动物医学学士学位,于2015年毕业于澳大利亚西澳大学获得博士学位,博士期间致力于雄性动物生殖学研究,博士期间以第一作者发表SCI论文5篇。博士毕业后加入宾夕法尼亚大学Jeremy Wang团队进行博士后训练,博士后期间主要从事减数分裂, piRNA通路以及转座子的研究。
该论文共同通讯作者罗孟成于2005年本科毕业于武汉大学生命科学学院,2010年博士毕业于武汉大学病毒学国家重点实验室,随后加入宾夕法尼亚大学Jeremy Wang课题组进行博士后训练。2016年入选中组部青年千人计划后回国入职武汉大学基础医学院,为人体解剖与组织胚胎学系教授,独立PI。罗孟成教授实验室专注男性不育的减数分裂调控机制研究,期望通过对减数分裂同源重组机制的系统研究为不孕不育诊治和体外生殖体系的建立提供理论依据。
该论文共同通讯作者Jeremy Wang教授自2002年加入宾夕法尼亚大学后一直致力于减数分裂和piRNA通路研究,该实验室做出的多种敲除小鼠对于生殖领域的进展贡献卓著,该实验室目前已发表高水平论文50余篇。由于Jeremy Wang教授在基础生殖研究领域的突出贡献,他荣获了在生殖领域享有盛誉的SSR (Society for the Study of Reproduction) 2020研究型奖章。
原文链接:https://advances.sciencemag.org/content/advances/6/13/eaaz2129.full.pdf
团队近几年代表性论文如下:1. Guan Y, Leu NA, Ma J, Chmátal L, Ruthel G, Bloom J, Lampson M, Schimenti J, Luo M﹡ & Wang PJ﹡ 2020 SKP1 drives the prophase I to metaphase I transition during male meiosis. Science Advances 6, eaaz2129.2. Shi B, Xue J, Yin H, Guo R, Luo M, Ye L, Shi Q, Huang X, Liu M, Sha J & Wang PJ 2019 Dual functions for the ssDNA-binding protein RPA in meiotic recombination. PLoS Genet 15 e1007952.3. Kasowitz SD, Ma J, Anderson SJ, Leu NA, Xu Y, Gregory BD, Schultz RM & Wang PJ 2018 Nuclear m6A reader YTHDC1 regulates alternative polyadenylation and splicing during mouse oocyte development. PLoS Genet 14 e1007412.4. Luo M, Zhou J, Leu NA, Abreu CM, Wang J, Anguera MC, de Rooij DG, Jasin M & Wang PJ 2015 Polycomb protein SCML2 associates with USP7 and counteracts histone H2A ubiquitination in the XY chromatin during male meiosis. PLoS Genet 11 e1004954.5. Vourekas A, Zheng K, Fu Q, Maragkakis M, Alexiou P, Ma J, Pillai RS, Mourelatos Z & Wang PJ 2015 The RNA helicase MOV10L1 binds piRNA precursors to initiate piRNA processing. Genes Dev 29 617-629.6. Yang F, Silber S, Leu NA, Oates RD, Marszalek JD, Skaletsky H, Brown LG, Rozen S, Page DC & Wang PJ 2015 TEX11 is mutated in infertile men with azoospermia and regulates genome-wide recombination rates in mouse. EMBO Mol Med 7 1198-1210.7. Luo M, Yang F, Leu NA, Landaiche J, Handel MA, Benavente R, La Salle S & Wang PJ 2013 MEIOB exhibits single-stranded DNA-binding and exonuclease activities and is essential for meiotic recombination. Nat Commun 4 2788.8. Zheng K, Xiol J, Reuter M, Eckardt S, Leu NA, McLaughlin KJ, Stark A, Sachidanandam R, Pillai RS & Wang PJ 2010 Mouse MOV10L1 associates with Piwi proteins and is an essential component of the Piwi-interacting RNA (piRNA) pathway. Proc Natl Acad Sci U S A 107 11841-11846.
来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652482750&idx=6&sn=d28c3c06be2dfa9c54ab6365f4b83e8a&chksm=84e23f0ab395b61c9f5b63a3663791363f65b4f4fdc809190cc48e0d9013c61d7c28deaad112#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn




