来源:BioArt
第一次减数分裂前期,细胞中的DNA发生断裂【1】。断裂的DNA会被同源重组修复,从而促进染色体的正常分裂以及同源染色体上DNA片段的交换【2】。依赖于MLH1-MLH3(MutLγ)的内切酶信号通路对减数分裂同源重组中间体(Intermediate)形成交叉(Crossovers)非常重要,但是具体分子机制的研究还很不清楚【3,4】。
为了揭开MLH1-MLH3(MutLγ)内切酶信号通路在减数分裂过程中染色体同源重组中的作用,近日,瑞士提契诺大学Petr Cejka研究组在Nature上发表文章Regulation of the MLH1-MLH3 endonuclease in meiosis,通过对预交叉信号通路重要元件进行体外生化重组后揭示了调节MLH1-MLH3内切酶在减数分裂中活性与功能的作用因子以及分子机制。

为了对人MLH1-MLH3进行研究,作者们首先在昆虫细胞中对该异源二聚体进行了表达和纯化。其中MLH3组分中包含金属结合结构基序,该结构域能够与金属锰离子共同发挥作用切割双链超螺旋DNA(Supercoiled DNA)。对该金属结合结构域进行突变后会使得该异源二聚体复合物的内切酶活性消失,说明DNA切割活性是该复合物的本质特征(图1)。另外作者们还发现ATP的加入则能够大大提高内切酶的活性(图1),该实验结果说明ATP的水解作用对于MLH1-MLH3异源二聚体复合物的DNA切割活性最大化是非常关键的。
图1 纯化的MLH1-MLH3异源二聚体对双链超螺旋DNA的切割作用
人MSH4-MSH5(MutSγ)是对同源重组交叉非常关键的另一个异源二聚体,能够结合在同源重组中间体上协助MLH1-MLH3复合物的作用【5】。MLH1-MLH3复合物具有结合到分支状结构例如Holliday交叉结构(Holliday junctions)的偏好性。同样地,MSH4-MSH5也能够结合Holliday交叉结构。这些研究结果给了作者们一个提示这两种异源二聚体复合物可能会在同源重组过程中发挥协同作用。通过凝胶电泳迁移实验作者们发现两种复合物的确会在DNA交叉位置处相互稳定,并且通过pull-down实验也证明了两种复合物之间存在直接地相互作用。
那么MSH4-MSH5复合物是如何影响MLH1-MLH3异源二聚体的功能的呢?通过体外重组系统,作者们发现MSH4-MSH5复合物能够提高MLH1-MLH3异源二聚体的内切酶活性达三倍之多。ATP的加入也会促进两种复合物对于DNA切割能力进一步提高。通过对其他的人MutS同源复合物进行检测,作者们发现除了MutSγ(MSH4-MSH5)复合物之外,MutSβ(MSH2–MSH3)也能够刺激MLH1-MLH3复合物内切酶活性到相似水平。
先前有研究表明出芽酵母中的Exo1能够在Mlh1-Mlh3预交叉信号通路中发挥结构性、内切酶非依赖的功能【6】。因此,作者们想知道Exo1是否会影响Mlh1-Mlh3内切酶的活性以及该调解作用在更高等的真核生物中是否保守。为了检测EXO1对于MLH1-MLH3复合物内切酶活性影响,作者们使用了核酸酶缺陷型EXO1变体EXO1(DA)加入体外系统中。EXO1核酸酶缺陷型变体能够阻止切割形成的DNA降解,有助于对具体调节作用的解析。作者们发现,EXO1能够有效促进MLH1-MLH3复合物与MSH4-MSH5复合物的内切酶活性。另外EXO1的加入对于MutSβ(MSH2–MSH3)与MLH1-MLH3复合物中内切酶活性酶没有太大影响,说明EXO1对MutLγ(MLH1-MLH3)与MutSγ(MSH4-MSH5)复合物内切酶活性的调节是非常特异的。
接下来作者们对于MLH1-MLH3异源二聚体及其辅助因子是否能在生理条件镁离子浓度条件下催化DNA切割进行检测。MLH1-MLH3复合物单独在生理浓度下的镁离子中几乎没有核酸酶活性,而MSH4-MSH5的加入产生较弱的切割能力,而内切酶的活性进一步受到EXO1(DA)的刺激(图2)。RFC-PCNA复合物对于MutLα复合物在错配修复中的核酸内切酶活性很重要,所以作者们想知道RFC-PCNA复合物对于MutLγ(MLH1-MLH3)调节功能。作者们发现RFC-PCNA复合物能够促进MLH1-MLH3复合物的核酸内切酶活性(图2),而且作者们发现MLH1-MLH3复合物能够与PCNA发生直接的相互作用。
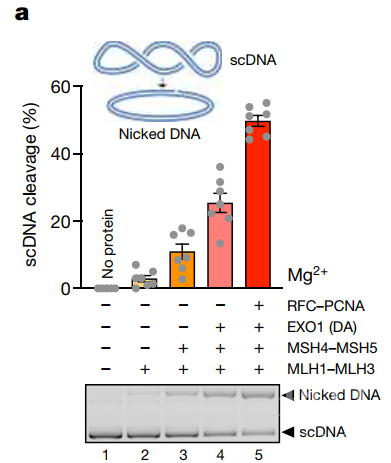
图2 核酸酶调节复合物RFC-PCNA-EXO1-MutSγ-MutLγ
总的来说,Cejka研究组的工作发现MutSγ、EXO1以及RFC-PCNA对于激活MutLγ复合物MLH1-MLH3在生理条件镁离子浓度下核酸内切酶活性非常关键,而且核酸内切酶复合物通过对Holliday交叉等双链DNA分支结构区域的结合偏好性对减数分裂交叉中间体进行切割,促进减数分裂的正常进行。
原文链接:https://doi.org/10.1038/s41586-020-2592-2参考文献
1.Keeney, S., Giroux, C. N. & Kleckner, N. Meiosis-specific DNA double-strand breaks are catalyzed by Spo11, a member of a widely conserved protein family. Cell 88, 375-384, doi:10.1016/s0092-8674(00)81876-0 (1997).
2.Hunter, N. Meiotic Recombination: The Essence of Heredity. Cold Spring Harbor perspectives in biology 7, doi:10.1101/cshperspect.a016618 (2015).
3.Zakharyevich, K., Tang, S., Ma, Y. & Hunter, N. Delineation of joint molecule resolution pathways in meiosis identifies a crossover-specific resolvase. Cell149, 334-347, doi:10.1016/j.cell.2012.03.023 (2012).
4.Svetlanov, A., Baudat, F., Cohen, P. E. & de Massy, B. Distinct functions of MLH3 at recombination hot spots in the mouse. Genetics 178, 1937-1945, doi:10.1534/genetics.107.084798 (2008).
5.Snowden, T., Acharya, S., Butz, C., Berardini, M. & Fishel, R. hMSH4-hMSH5 recognizes Holliday Junctions and forms a meiosis-specific sliding clamp that embraces homologous chromosomes. Molecular cell 15, 437-451, doi:10.1016/j.molcel.2004.06.040 (2004).
6. Zakharyevich, K. et al. Temporally and biochemically distinct activities of Exo1 during meiosis: double-strand break rep and resolution of double Holliday junctions. Molecular cell 40, 1001-1015, doi:10.1016/j.molcel.2010.11.032 (2010).
来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652497681&idx=3&sn=f2be39e601a9db60c621d88efcd26f6a&chksm=84e274a5b395fdb36008b23fdaa1b31579d47a422dc7a9a29616e009c98699a54940d6ba4382#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



