内容来源:中国科技大学合肥微物质研究中心
癌基因cMyc是一个重要的转录因子,调控约15%的人类基因表达,在肿瘤细胞的增殖、凋亡以及代谢重编程等方面发挥重要作用。然而,目前尚不清楚,cMyc是否通过转录以外的机制,来广泛地调控基因的表达以及肿瘤的发生发展。
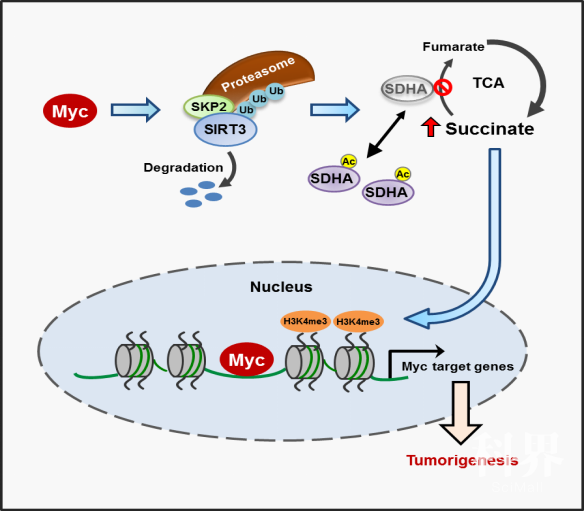
中国科学技术大学的张华凤课题组、高平课题组联合军事医学科学院段小涛课题组的研究发现,cMyc能够促使琥珀酸脱氢复合酶(SDH complex)中的重要亚基SDHA乙酰化以及SDH复合酶失活,导致底物琥珀酸(succinate)的积累,进而上调组蛋白H3K4的三甲基化(H3K4Me3)水平以及基因的表达。机制方面,发现cMyc通过泛素连接酶SKP2促进线粒体中SIRT3的蛋白降解,从而导致SDHA的乙酰化上升。通过质谱进一步鉴定出SDHA受调控的乙酰化位点K335,小鼠实验显示SDHA的K335位点乙酰化在cMyc诱导肿瘤过程中起重要作用。进一步分析临床病人弥散性大B细胞瘤(DLBCL)样本发现,高表达cMyc的DLBCLs中,SIRT3发挥着抑癌因子的功能,而K335位乙酰化的SDHA发挥着促进肿瘤的作用。这一发现揭示了cMyc驱动的肿瘤发生过程中SDHA乙酰化修饰发挥的重要病理学作用。SDHA被认为是抑癌蛋白,它的失活突变体与多种肿瘤,例如副神经结瘤、乳腺癌、肾癌等,有一定程度的联系。我们的这项研究表明,至少在弥散性大B细胞淋巴瘤中,SDHA通过乙酰化失活而极大地促进了cMyc异常表达的肿瘤的进展。因此,靶向SDHA的乙酰化将可能为此类肿瘤的临床治疗提供潜在的策略和手段。
该论文以“Myc-mediated SDHA acetylation triggers epigenetic regulation of gene expression and tumorigenesis”为题,3月16号在线发表于Nature Metabolism期刊。中国科学技术大学生命学院的李世庭博士和黄的博士为该论文的共同第一作者,中国科学技术大学的张华凤教授、高平教授和军事医学科学院的段小涛教授为论文的共同通讯作者。这项工作得到了安徽医科大学蔡永萍课题组、军事医学科学院李爱玲课题组、中国科大周荣斌课题组和瞿昆课题组的大力帮助。
论文链接:https://www.nature.com/articles/s42255-020-0179-8
来源:中国科技大学合肥微物质研究中心
原文链接:http://www.hfnl.ustc.edu.cn/detail?id=16557
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn