来源:X一MOL资讯
翻译后修饰(Post-translational modification,PTM)有效地扩展了自然界的遗传密码。据估计,人类蛋白质组中的将近5%,由负责添加或去除PTM的酶组成。化学修饰剂,如泛素、磷酸盐、脂质和聚糖等,会影响其结合蛋白质的定位、活性和稳定性。众所周知,选择性影响靶标蛋白质的PTM可能是调节其功能的有效手段。近来有研究表明,一类翻译后修饰酶——E3泛素连接酶可用于促进靶标蛋白质的降解。在这种策略中,双功能小分子两端分别与靶标蛋白质和E3泛素连接酶结合,拉近二者距离,促进靶蛋白质泛素化,随后被蛋白质酶体识别和降解。这些小分子被证明是诱导多种目标蛋白质降解的有效工具。近日,美国Genentech公司Steven T. Staben与Sayumi Yamazoe等研究者借鉴了这种策略,开发了一种灵活而通用的工具来调控靶标蛋白质的另一种翻译后修饰——去磷酸化。激酶和磷酸酶可分别促进蛋白质丝氨酸、苏氨酸和酪氨酸残基的磷酸化和去磷酸化,这一可逆过程可导致较大的蛋白质构象变化,从而改变蛋白质功能,涉及许多细胞生理活性的调控。他们设计了一类双功能小分子,一端结合靶标蛋白质,另一端结合磷酸酶1(PP1),拉近二者距离促进靶标蛋白质的去磷酸化。实验证明,这种策略可以实现蛋白激酶B(AKT)和表皮生长因子受体(EGFR)的去磷酸化。相关工作发表于 Journal of Medicine Chemistry 上。
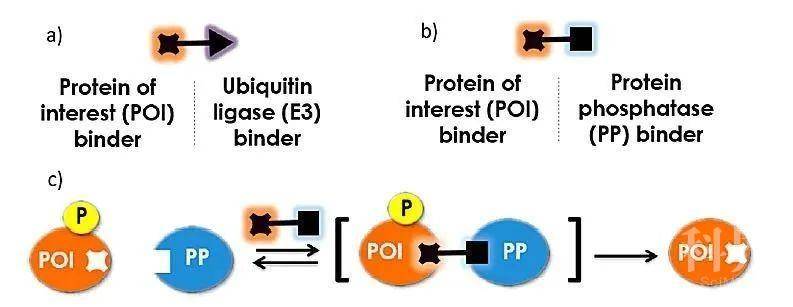
该课题组首先设计并合成了化合物1(图2a),该化合物一端为AKT抑制剂(用于结合AKT),另一端为可以与带HaloTag的蛋白质进行化学选择性反应的氯代烷基基团(用于结合带HaloTag的PP1)。用编码带HaloTag的PP1融合蛋白质的载体转染LNCaP细胞,与对照细胞相比,10 μM化合物1处理可显著降低细胞中AKT的磷酸化水平。他们在MCF7 / neo HER2和PC-3细胞中也观察到了类似的结果。这些表明,双功能小分子化合物1在细胞中能将PP1募集到目标蛋白质AKT附近,并促进磷酸化AKT(pAKT)去磷酸化。
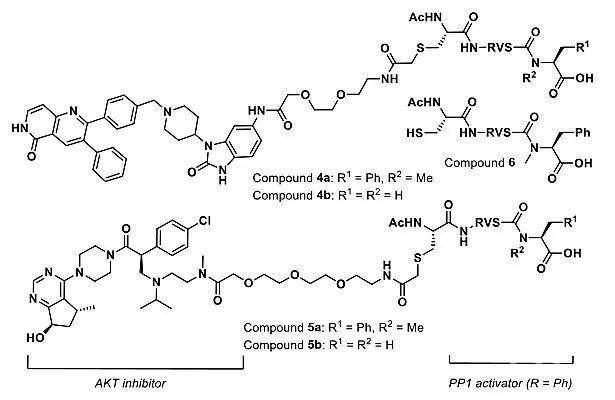
接下来,该课题组采用了第二种方法进行概念验证,就是在小分子的两端分别引入可以选择性结合靶标蛋白和磷酸酶的基团。他们设计的小分子化合物3(图3a),一端引入AKT抑制剂(用于结合AKT),另一端引入可以选择性激活PP1的多肽PDP1(用于结合PP1)。相对于AKT抑制剂2,双功能小分子3可以更大程度降低AKT磷酸化水平。再结合PDP1和双功能分子3的竞争实验结果,小分子3促进的pAKT和PP1的接近足以促进前者去磷酸化。
不过,可能是由于小分子3中的PDP1肽比较长,细胞渗透性或稳定性较差,小分子3在LNCap 细胞中并不能降低pAKT水平。于是,他们采用了更短的PP1结合肽——四肽RVSF,以及两种不同的AKT抑制剂,得到两种双功能小分子4a和5a(图4a)。细胞实验证明,与引入不能结合PP1的四肽的双功能小分子4b和5b相比(图4a),4a和5a可以明显降低pAKT水平。
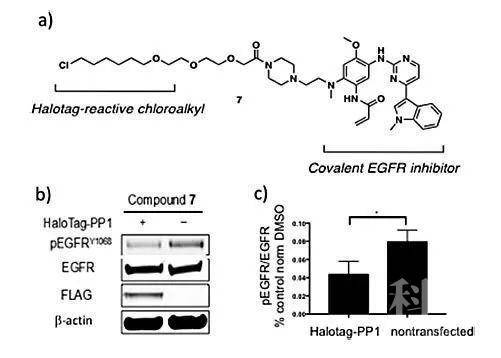
接下来,该课题组继续证明了这种策略可用于另一种激酶EGFR。EGFR在其C末端尾部具有五个自磷酸化位点,在癌细胞中极易被磷酸化,从而激活癌细胞的下游信号通路,并促进癌细胞增殖、分化。他们将EGFR抑制剂AZD-929126(Tagrisso,用于结合EGFR)和氯代烷基基团(用于结合带HaloTag的PP1)桥接在一起,得到双功能小分子7。与对照相比,10 μM化合物7能明显降低细胞中的酪氨酸残基磷酸化EFGR(pEGFRY1068)水平。这不仅表明化合物7能够促进pEGFR去磷酸化,还表明丝氨酸/苏氨酸磷酸酶PP1能够克服了典型的底物选择性,使磷酸化的酪氨酸残基去磷酸化。
小结
这项工作首次验证了使用小分子化合物将磷酸酶募集到靶标蛋白质附近以促进其去磷酸化过程的概念。研究者利用双功能小分子促进了两种激酶AKT和EGFR的去磷酸化,拓展了双功能小分子在生命科学及医学中的应用潜力。
原文:Heterobifunctional Molecules Induce Dephosphorylation of Kinases−A Proof of Concept StudySayumi Yamazoe, Jeffrey Tom, Yue Fu, Wenqiong Wu, Liang Zeng, Changlei Sun, Qi Liu, Jie Lin, Kui Lin, Wayne J. Fairbrother, Steven T. StabenJ. Med. Chem., 2020, DOI: 10.1021/acs.jmedchem.9b01167
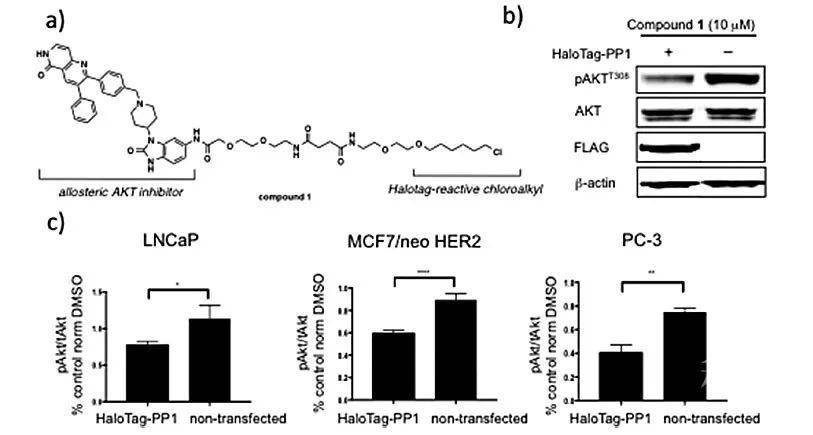
接下来,该课题组采用了第二种方法进行概念验证,就是在小分子的两端分别引入可以选择性结合靶标蛋白和磷酸酶的基团。他们设计的小分子化合物3(图3a),一端引入AKT抑制剂(用于结合AKT),另一端引入可以选择性激活PP1的多肽PDP1(用于结合PP1)。相对于AKT抑制剂2,双功能小分子3可以更大程度降低AKT磷酸化水平。再结合PDP1和双功能分子3的竞争实验结果,小分子3促进的pAKT和PP1的接近足以促进前者去磷酸化。
不过,可能是由于小分子3中的PDP1肽比较长,细胞渗透性或稳定性较差,小分子3在LNCap 细胞中并不能降低pAKT水平。于是,他们采用了更短的PP1结合肽——四肽RVSF,以及两种不同的AKT抑制剂,得到两种双功能小分子4a和5a(图4a)。细胞实验证明,与引入不能结合PP1的四肽的双功能小分子4b和5b相比(图4a),4a和5a可以明显降低pAKT水平。
接下来,该课题组继续证明了这种策略可用于另一种激酶EGFR。EGFR在其C末端尾部具有五个自磷酸化位点,在癌细胞中极易被磷酸化,从而激活癌细胞的下游信号通路,并促进癌细胞增殖、分化。他们将EGFR抑制剂AZD-929126(Tagrisso,用于结合EGFR)和氯代烷基基团(用于结合带HaloTag的PP1)桥接在一起,得到双功能小分子7。与对照相比,10 μM化合物7能明显降低细胞中的酪氨酸残基磷酸化EFGR(pEGFRY1068)水平。这不仅表明化合物7能够促进pEGFR去磷酸化,还表明丝氨酸/苏氨酸磷酸酶PP1能够克服了典型的底物选择性,使磷酸化的酪氨酸残基去磷酸化。
小结
这项工作首次验证了使用小分子化合物将磷酸酶募集到靶标蛋白质附近以促进其去磷酸化过程的概念。研究者利用双功能小分子促进了两种激酶AKT和EGFR的去磷酸化,拓展了双功能小分子在生命科学及医学中的应用潜力。
原文:Heterobifunctional Molecules Induce Dephosphorylation of Kinases−A Proof of Concept StudySayumi Yamazoe, Jeffrey Tom, Yue Fu, Wenqiong Wu, Liang Zeng, Changlei Sun, Qi Liu, Jie Lin, Kui Lin, Wayne J. Fairbrother, Steven T. StabenJ. Med. Chem., 2020, DOI: 10.1021/acs.jmedchem.9b01167
来源:X-molNews X一MOL资讯
原文链接:http://mp.weixin.qq.com/s?__biz=MzAwOTExNzg4Nw==&mid=2657630156&idx=2&sn=2081769300f10410c7743e11f582ed79&chksm=80f81e1cb78f970a7aec833cfe07c4f35bce57c475eea227108b107e8ebf8ae3a8d64f66da2d&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn