来源:BioWorld
目前新冠病毒肺炎疫情在全球范围内呈现扩散趋势,在全球80多个国家和地区感染例数正急剧增多,因此对于开发快速且可靠的诊断试剂需求愈加强烈。自新冠疫情爆发以来,国内近百家企业积极投入检测试剂研发。
1月26日,之江生物、捷诺生物和华大生物取得国家药监局颁发的第一批新型冠状病毒核酸检测试剂盒医疗器械注册证。1月28日,达安基因、圣湘生物新型冠状病毒2019-nCoV核酸检测试剂盒(荧光PCR法)通过国家药品监督管理局审批。1月31日,伯杰医疗新型冠状病毒2019-nCoV核酸检测试剂盒(荧光PCR法)通过国家药品监督管理局审批。
2月22日,国家药品监督管理局再次应急审批通过万孚生物、英诺特生物、博奥晶芯生物3家企业3个新型冠状病毒检测产品,包括2个胶体金法抗体检测试剂、1个恒温扩增芯片法核酸检测试剂,扩大了新型冠状病毒的检测方法和手段,全力服务疫情防控需要。3月2日,国家药品监督局正式批准了4款新型冠状病毒检测产品,分别是:北京卓诚惠生生物科技股份有限公司“新型冠状病毒(2019-nCoV)核酸检测试剂盒(荧光PCR法)”;迈克生物科技股份有限公司“新型冠状病毒(2019-nCoV)核酸检测试剂盒(荧光PCR法)”;博奥赛斯(重庆)生物有限公司“新型冠状病毒(2019-nCoV)IgM抗体检测试剂盒(磁微粒化学发光法)”和“新型冠状病毒(2019-nCoV)IgG抗体检测试剂盒(磁微粒化学发光法)”。
3月3日,达安基因表示,公司新型冠状病毒核酸检测试剂盒已获得欧盟CE认证,正式走向国际市场。3月6日,国家药品监督管理局应急审批通过厦门万泰凯瑞生物技术有限公司1个新型冠状病毒2019-nCoV抗体检测试剂盒(化学发光微粒子免疫检测法)。截至目前,国家药品监督管理局共批准新冠病毒核酸检测试剂10个,抗体检测试剂5个。如下表: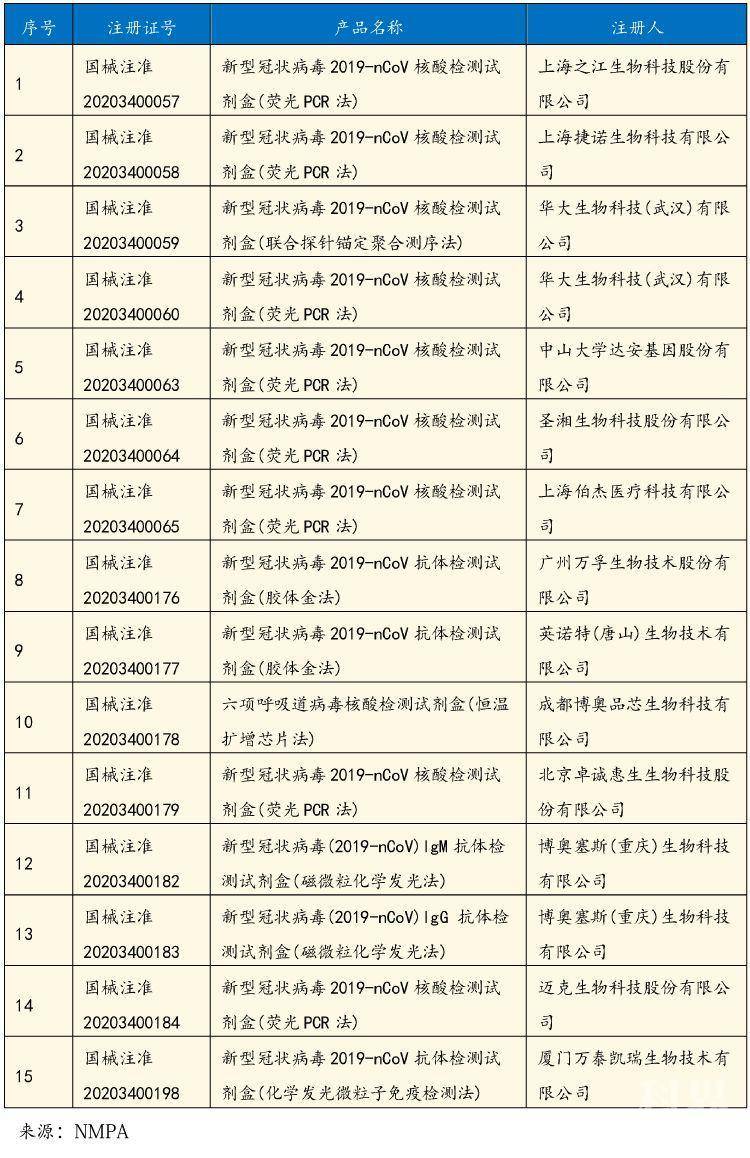 其他新型冠状病毒检测试剂研发企业进展信息梳理:
其他新型冠状病毒检测试剂研发企业进展信息梳理: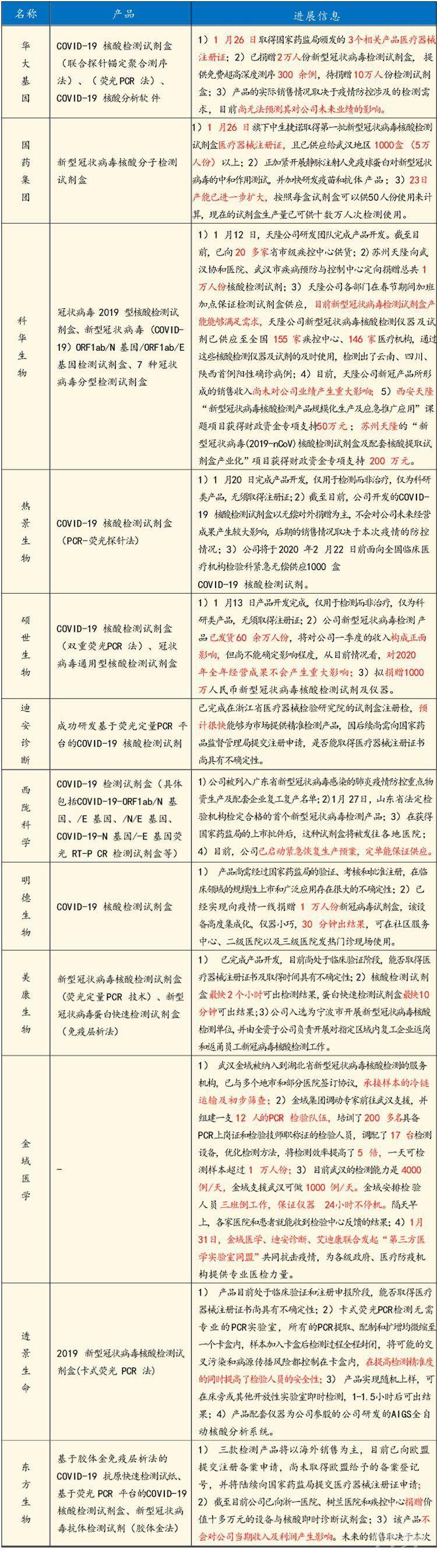 来源:国金证券股份有限公司目前新冠病毒检测方法主要有:实时荧光RT-PCR法检测病毒核酸、高通量基因组测序(mNGS)和对病毒感染后人体血清中的免疫球蛋白 IgM/IgG 检测的胶体金免疫层析法(POCT)和酶联免疫吸附测定(ELISA)检测。其中,实时荧光RT-PCR法快速简便、成本较低、在临床中已被广泛使用,在获批的新型冠状病毒核酸检测试剂盒产品中占了大部分。为了推动我国新冠病毒检测试剂向规范化、标准化方向发展,我们特别邀请到中山大学达安基因股份公司研发总监蒋析文先生为大家分享“分子诊断技术在2019-nCoV检测中的应用”这一热门话题。
来源:国金证券股份有限公司目前新冠病毒检测方法主要有:实时荧光RT-PCR法检测病毒核酸、高通量基因组测序(mNGS)和对病毒感染后人体血清中的免疫球蛋白 IgM/IgG 检测的胶体金免疫层析法(POCT)和酶联免疫吸附测定(ELISA)检测。其中,实时荧光RT-PCR法快速简便、成本较低、在临床中已被广泛使用,在获批的新型冠状病毒核酸检测试剂盒产品中占了大部分。为了推动我国新冠病毒检测试剂向规范化、标准化方向发展,我们特别邀请到中山大学达安基因股份公司研发总监蒋析文先生为大家分享“分子诊断技术在2019-nCoV检测中的应用”这一热门话题。
 其他新型冠状病毒检测试剂研发企业进展信息梳理:
其他新型冠状病毒检测试剂研发企业进展信息梳理: 来源:国金证券股份有限公司目前新冠病毒检测方法主要有:实时荧光RT-PCR法检测病毒核酸、高通量基因组测序(mNGS)和对病毒感染后人体血清中的免疫球蛋白 IgM/IgG 检测的胶体金免疫层析法(POCT)和酶联免疫吸附测定(ELISA)检测。其中,实时荧光RT-PCR法快速简便、成本较低、在临床中已被广泛使用,在获批的新型冠状病毒核酸检测试剂盒产品中占了大部分。为了推动我国新冠病毒检测试剂向规范化、标准化方向发展,我们特别邀请到中山大学达安基因股份公司研发总监蒋析文先生为大家分享“分子诊断技术在2019-nCoV检测中的应用”这一热门话题。
来源:国金证券股份有限公司目前新冠病毒检测方法主要有:实时荧光RT-PCR法检测病毒核酸、高通量基因组测序(mNGS)和对病毒感染后人体血清中的免疫球蛋白 IgM/IgG 检测的胶体金免疫层析法(POCT)和酶联免疫吸附测定(ELISA)检测。其中,实时荧光RT-PCR法快速简便、成本较低、在临床中已被广泛使用,在获批的新型冠状病毒核酸检测试剂盒产品中占了大部分。为了推动我国新冠病毒检测试剂向规范化、标准化方向发展,我们特别邀请到中山大学达安基因股份公司研发总监蒋析文先生为大家分享“分子诊断技术在2019-nCoV检测中的应用”这一热门话题。来源:ibioworld BioWorld
原文链接:https://mp.weixin.qq.com/s?__biz=MzU1MzMxMzcyMg==&mid=2247497594&idx=8&sn=afd0e7d45dd60f380ae82094431db41a&chksm=fbf603afcc818ab9f0ce641ec6ac1dbed0dea5296ae26b08a2314473bb59a96f3432510402c5#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



