来源:BioArt
撰文 | 十一月广泛中和抗体(Broadly neutralizing antibodies, bNAbs)是目前用于治疗HIV-1感染的可行性方式之一【1-3】。研究表明在感染HIV-1的患者中,抗病毒治疗(Antiretroviral therapy , ART)中断后,bNAbs可抑制病毒血症并延迟病毒反弹【4,5】。但是HIV病毒包膜糖蛋白的突变使得病毒会逃脱体内中和抗体的作用因而限制了中和抗体在临床方面的应用。 近日,德国科隆大学Florian Klein研究组在Cell发文Restriction of HIV-1 Escape by a Highly Broad and Potent Neutralizing Antibody,通过筛选得到了中和抗体1-18,该中和抗体能够有效限制病毒逃逸并维持中和抗体活性,实验发现该中和抗体具有治疗和阻止HIV-1的感染的功能,成为抗体介导的HIV-1治疗的备选策略之一。

近年来,从HIV-1感染的供体中可以分离出强效的bNAb,这些中和抗体的靶标是包膜蛋白三聚体中的不同表位。其中包括CD4结合位点(CD4 binding site, CD4bs)、V1/V2环、V3环多糖片、膜近端外部区域以及gp120和gp41亚基的表面等等【6】。在这些位点中,CD4结合位点由于CD4作为病毒进入体内的主要受体而备受科学家关注【7-9】。 为了鉴定出携带有优秀HIV-1中和抗体活性的个体,作者们筛选了2,274个HIV-1感染的受试者。每个个体的血清或者是血清免疫球蛋白IgG被纯化后进行中和抗体活性的检测。在其中筛选得到了VH1-46衍生的B细胞克隆4是具有较高潜能、广泛的中和血清活性的抗体。克隆4中比较有代表性两个抗体是1-18和1-55,作者们对此两个抗体进行了进一步地分析。其中1-18具有较强的活性,比目前为止的CD4结合位点上广泛中和抗体可能还要更胜一筹。
进一步地,作者们希望揭开1-18识别包膜蛋白的具体结构机制,解析了1-18与包膜蛋白三聚体的冷冻电镜结构,分辨率达到了2.5 Å。通过该结构解析的结果发现1-18靶点在CD4的结合位点,临近在gp120启动子区域。1-18抗体介导的HIV-1中和活性主要是由于1-18在gp120表面增加的启动子区域内的相互作用。 经过体外实验检测后发现,1-18中和抗体的活性不会受到已知的典型包膜蛋白逃逸突变的影响。为了进一步确认1-18中和抗体是否存在潜在的病毒逃逸突变位点,作者们进行了突变抗原分析,对病毒包膜蛋白的跨膜结构域和胞外结构域中所有的核苷酸进行了突变检测【10】。在此检测中,作者们通过对细胞的深度测序来对包膜蛋白突变与抗体抗性的影响进行定量测量。
通过此实验,作者们发现1-18抗体只对病毒上一小部分碱基的突变会引发病毒的逃逸,而这些所有的突变都位于经典的CD4结合位点之外。通过在HIV-1感染的类人小鼠中施用1-18中和抗体,作者们发现在体内1-18能够完全抑制病毒血症。而且在体内也同样能够克服病毒一些经典突变位点引发的病毒逃逸。 总的来说,Florian Klein研究组的工作通过筛选得到的抗体1-18是有效的广泛中和抗体,能够阻止和治疗HIV-1的感染。中和抗体1-18靶向HIV-1的CD4结合位点。相比于其他的CD4结合位点的抗体来说,1-18在体内能够有效抑制HIV-1感染并且限制病毒突变逃逸。总之,通过结合有效的中和活性和高水平的病毒逃逸屏障,1-18为高效治疗和预防HIV-1感染提供了新的选择。
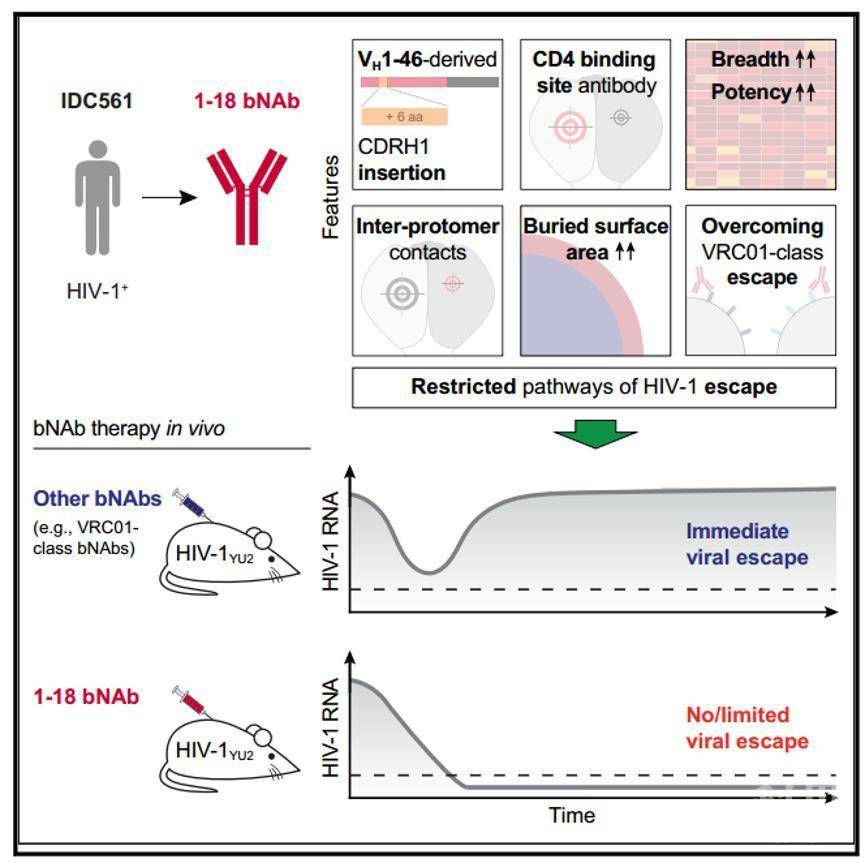 图1 1-18中和抗体工作模型
图1 1-18中和抗体工作模型
原文链接:https://www.sciencedirect.com/science/article/pii/S009286742030057X
 图1 1-18中和抗体工作模型
图1 1-18中和抗体工作模型原文链接:https://www.sciencedirect.com/science/article/pii/S009286742030057X
参考文献
1. Balazs, A. B. et al. Antibody-based protection against HIV infection by vectoredimmunoprophylaxis. Nature 481, 81-84, doi:10.1038/nature10660(2011).2. Gautam,R. et al. A single injection ofanti-HIV-1 antibodies protects against repeated SHIV challenges. Nature 533, 105-109, doi:10.1038/nature17677 (2016).3. Julg,B. & Barouch, D. H. Neutralizing antibodies for HIV-1 prevention. Curr Opin HIV AIDS 14, 318-324, doi:10.1097/COH.0000000000000556 (2019).4. Bar,K. J. et al. Effect of HIV AntibodyVRC01 on Viral Rebound after Treatment Interruption. N Engl J Med 375,2037-2050, doi:10.1056/NEJMoa1608243 (2016).5. Bar-On,Y. et al. Safety and antiviralactivity of combination HIV-1 broadly neutralizing antibodies in viremicindividuals. Nat Med 24, 1701-1707,doi:10.1038/s41591-018-0186-4 (2018).6. Gama,L. & Koup, R. A. New-Generation High-Potency and Designer Antibodies: Rolein HIV-1 Treatment. Annu Rev Med 69, 409-419,doi:10.1146/annurev-med-061016-041032 (2018).7. Maddon,P. J. et al. The T4 gene encodes theAIDS virus receptor and is expressed in the immune system and the brain. Cell 47, 333-348, doi:10.1016/0092-8674(86)90590-8 (1986).8. Kwong,P. D. et al. Structure of an HIVgp120 envelope glycoprotein in complex with the CD4 receptor and a neutralizinghuman antibody. Nature 393, 648-659, doi:10.1038/31405 (1998).9. Zhou,T. et al. Structural definition of aconserved neutralization epitope on HIV-1 gp120. Nature 445, 732-737,doi:10.1038/nature05580 (2007).10. Dingens,A. S., Haddox, H. K., Overbaugh, J. & Bloom, J. D. Comprehensive Mapping ofHIV-1 Escape from a Broadly Neutralizing Antibody. Cell Host Microbe 21,777-787 e774, doi:10.1016/j.chom.2017.05.003 (2017).来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652481656&idx=6&sn=e337ff5f5740d09d10c12c00006bf5a9&chksm=84e23bccb395b2daed18a1d52fbe80b1d24acc228ef7cc5c9e3f4e195eab86371f2c0a204f40&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



