来源:生物谷
原标题:首个植物来源大麻素新型抗癫痫药!Epidiolex美国申请新适应症,治疗结节性硬化症(TSC)相关癫痫
Epidiolex之前已被FDA授予治疗TSC的孤儿药名称,TSC是一种罕见的、严重的、儿童期发生的遗传性疾病。癫痫是TSC最常见的神经学特征,多达三分之二的TSC患者会经历药物难治性癫痫发作,在解决与TSC相关癫痫发作方面,对新的治疗方法存在着重大需求。来自III期临床研究的数据显示,与安慰剂相比,Epidiolex显著减少了TSC相关的难治性癫痫发作(包括局灶性和全身性),并改善了患者的整体状况。如果获得批准,Epidiolex将为TSC患者群体提供一个重要的治疗选择。
此次sNDA基于一项随机、双盲、安慰剂对照III期临床研究的结果。该研究共入组了224例(年龄1-65岁)被确诊为对治疗有抵抗(难治性)的TSC患者,这些患者被随机分配接受Epidiolex 25mg/公斤/天(n=75)、Epidiolex 50mg/公斤/天(n=73)、安慰剂(n=76),治疗16周(4周滴定期、12周维持期)。主要终点是治疗期间Epidiolex与安慰剂相比TSC相关局灶性和全身性癫痫发作频率相对基线的百分比变化。关键的次要终点包括:癫痫发作减少≥50%的患者比例、总发作频率(包括局灶性感觉和癫痫痉挛)减少≥50%的患者比例,受试者/照料者整体状况变化的总体印象(S/CGIC)。
结果显示,研究达到了主要终点,与安慰剂组相比,Epidiolex治疗组TSC相关癫痫发作频率显著降低:Epidiolex 25mg/kg/天治疗组、50mg/kg/天治疗组相对基线分别降低49%、48%,安慰剂组降低29%(p=0.0009,p=0.00118)。
所有关键次要终点的结果均支持对主要终点的影响。具体为:(2)与安慰剂组相比,Epidiolex治疗组有更高比例的患者癫痫发作减少50%或更大幅度的减少(25mg/kg/天组为36%、50mg/kg/天组为40%,安慰剂组为22%,p=0.0692和p=0.0245)。(2)与安慰剂组相比,2种剂量Epidiolex治疗组均有48%的患者总发作频率(包括局灶性感觉和癫痫痉挛)经历了更大幅度的减少,安慰剂组为27%(p=0.0013和p=0.0018)。(3)根据患者/照料者总体印象(S/CGIC)问卷调查结果,Epidiolex 25mg/kg/天组、Epidiolex 50mg/kg/天组报告整体状况得到改善的比例分别为69%、62%、安慰剂组为39%(p=0.0074和p=0.0580)。(4)额外的分析显示,Epidiolex治疗患者与安慰剂患者相比在复合局灶性癫痫发作方面经历了更大幅度的减少(25mg/kg/天治疗组、50mg/kg/天治疗组患者比例分别为52%、50%,安慰剂组比例为32%,p=0.0076和p=0.0116)。
该研究中观察到的安全概况与之前的研究结果一致,没有发现新的安全风险。不良事件(AE)发生率在25mg/kg/天组为93%、50mg/kg/天组为100%、安慰剂组为95%。两种剂量都具有可接受的安全性,25 mg/kg/天的不良事件少于50 mg/kg/天。最常见的不良反应是腹泻、食欲下降和嗜睡。
结节性硬化症(TSC)是一种罕见的遗传病,影响美国约5万人、全球近100万人。在全球范围内,每天至少有2例TSC婴儿诞生,估计每6000个新生儿中就有一个。该病主要是导致良性肿瘤在身体的重要器官中生长,包括大脑、皮肤、心脏、眼睛、肾脏和肺,是导致遗传性癫痫的主要原因。TSC通常在出生后的第一年发生,表现为局灶性癫痫或婴儿痉挛,并与孤独症和智力残疾的风险增加有关。病情的严重程度可能有很大差异。在一些儿童中,这种疾病非常轻微,而另一些儿童则可能出现危及生命的并发症。约85%的TSC患者存在癫痫,并可能发展为对药物难治。超过60%的TSC患者不能通过标准治疗如抗癫痫药物、癫痫手术、生酮饮食或迷走神经刺激等来控制癫痫发作,相比之下,30-40%的无TSC的癫痫患者是耐药的。
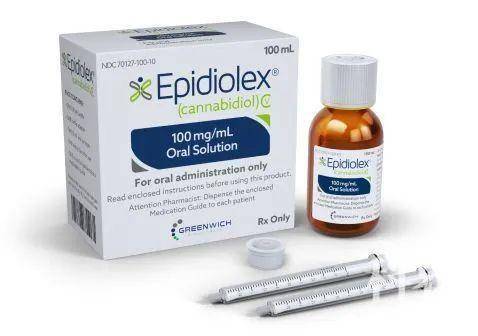
Epidiolex(欧洲商品名为:Epidyolex)是一种口服的、高纯度CBD提取物液体制剂,CBD是一种来自大麻植物的非精神类成分,对于神经系统具有多种药理作用。大量的研究表明,CBD具有明显的抗癫痫和抗惊厥活性,相比现有抗癫痫药物副作用更少。
在美国,Epidiolex口服液体制剂于2018年6月获得FDA批准,用于2岁及以上患者,辅助治疗与Lennox-Gastaut综合征(LGS)和Dravet综合征(DS)相关的癫痫。在欧盟,Epidyolex于2019年6月获批上述相同的适应症。LGS和DS是2种罕见的、严重的、儿童期发病的癫痫,也是最难以治疗的癫痫类型。在美国,FDA之前已授予Epidiolex治疗LGS和DS的罕见儿科疾病孤儿药地位。
在美国,Epidiolex口服液体制剂于2018年6月获得FDA批准,用于2岁及以上患者,辅助治疗与Lennox-Gastaut综合征(LGS)和Dravet综合征(DS)相关的癫痫。在欧盟,Epidyolex于2019年6月获批上述相同的适应症。LGS和DS是2种罕见的、严重的、儿童期发病的癫痫,也是最难以治疗的癫痫类型。在美国,FDA之前已授予Epidiolex治疗LGS和DS的罕见儿科疾病孤儿药地位。
此外,FDA还授予了Epidiolex治疗DS的快速通道地位。在欧洲,Epidyolex也被EMA授予了治疗LGS和DS的孤儿药地位。
Epidiolex/Epidyolex是美欧批准治疗癫痫的首个植物来源大麻素药物,也是首个新型抗癫痫药物(AED)。业界对该药的商业前景十分看好。科睿唯安此前预测,该在2022年的销售额将达到12亿美元。
Epidiolex/Epidyolex是美欧批准治疗癫痫的首个植物来源大麻素药物,也是首个新型抗癫痫药物(AED)。业界对该药的商业前景十分看好。科睿唯安此前预测,该在2022年的销售额将达到12亿美元。
目前,GW制药公司正在开发Epidiolex/Epidyolex用于治疗包括TSC和Rett综合征在内的其他罕见病。GW公司推出了全球首个植物来源的大麻素处方药Sativex(nabiximols),该药在美国以外的许多多家被批准,用于治疗多发性硬化症的痉挛;该公司正在推进Sativex的一个后期项目,以寻求FDA批准。该公司管线中有一系列大麻素候选产品,包括治疗癫痫、自闭症、胶质母细胞瘤、精神分裂症的化合物。
原文出处:Pharmaceuticals and Greenwich Biosciences Submit Supplemental New Drug application to U.S. FDA for Epidiolex? (cannabidiol) for the Treatment of Tuberous Sclerosis Complex
来源:BIOONNEWS 生物谷
原文链接:https://mp.weixin.qq.com/s?__biz=MzI2NjY1NjA5Mw==&mid=2247506074&idx=3&sn=c6550bc03f8fb6d5dccbf04e5b6533b3&chksm=ea8858a8ddffd1be71672844b0294d39276e3f988f0222fa578e15b06c98e539a4ab2c70ac49#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn