来源:brainnews
在【脑科学研究攻略】专栏,brainnews特邀的作者将给大家分享他们总结的一些研究思路,供大家学习和借鉴,欢迎留言一起交流。随着病毒示踪技术的发展,脑区之间有着不同遗传特异性的神经环路可以被更透彻的解析出来。最近两年内,有很多研究小组致力于寻找目标行为在大脑中完整的神经环路以及其环路上下游在行为中的功能的区别。
其中,有部分研究专注于探究三级环路(存在顺序投射关系的三个脑区)在不同行为范式中的信息传递与调控功能。下面笔者就用几个近两年内不同课题组的研究成果做一个简要的介绍。

图源:Medical News Today
CA2→dLS/vLS→VMHvl环路在社交攻击性行为中的作用
该工作由哥伦比亚大学Steven A. Siegelbaum研究小组于2018年12月在Nature上发表。该课题组一直致力于研究海马CA2区在小鼠社交相关行为中的功能。早在2014年该小组就在Nature上发表相关研究,他们利用构建的Amigo2–Cr转基因鼠特异性地标记了海马CA2区神经元,并证实了CA2在社交行为中的作用。但是,当时的研究并没有涉及到CA2的上下游环路。
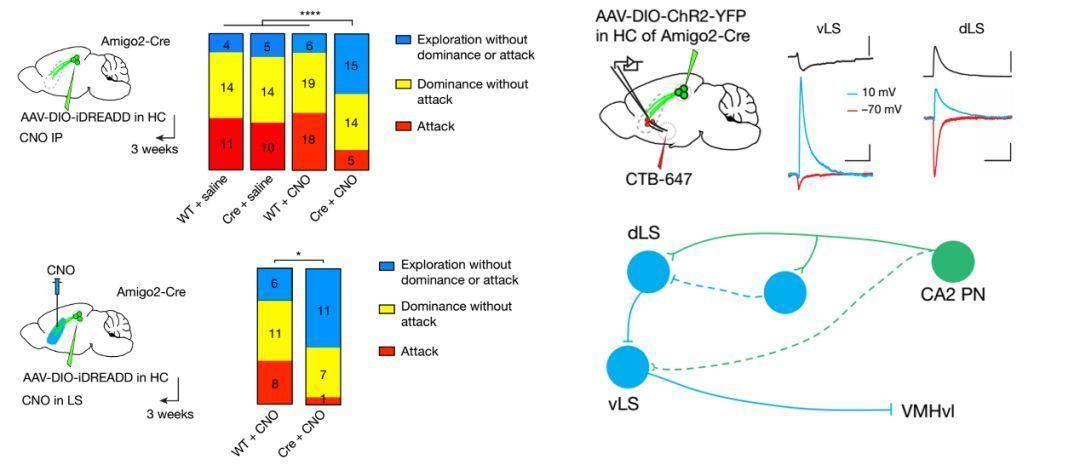
在观察到标记CA2神经元之后,该课题组接下去的研究利用狂犬病毒标记发现CA2神经元的纤维延伸到背侧外侧隔核(dLS)。通过全细胞膜片钳记录发现,用光遗传激活来自CA2的纤维可以显著激活dLS神经元产生动作电位。随后利用化学遗传学套管给药的方式发现抑制CA2-dLS环路可以减少小鼠之间的攻击频率。
研究人员接着利用全细胞膜片钳对LS区的神经元进行记录发现LS区神经元在受到激活CA2投射的信号后有两类神经元有不同的反应。其中背侧dLS神经元可以被CA2的投射激活;而腹侧vLS的神经元则被抑制。结合其他的文献报道vLS神经元可以投射到腹内侧下丘脑的腹外侧亚核(ventrolateral subnucleus of the ventromedial hypothalamus,VMHvl),也就是控制攻击性行为的最重要的脑区。
至此一个调控小鼠攻击性行为的三级环路就较为清晰的浮现出来了:CA2的锥体神经元通过激活dLS神经元进而抑制vLS的神经元活动性;vLS本身对VMHvL形成抑制性投射。从而我们可以得出,激活CA2通过vLS对VMHvl产生去抑制化效应,进而增加小鼠的攻击性行为。
SCNVIP→SPZGABA→(VMHc)→VMHvl环路在节律对攻击性行为的调控作用
VMHvl控制的攻击性行为不仅受到海马CA2依赖的社交记忆相关环路的调控,也受到下丘脑上交叉晶状体核(suprachiasmatic nucleus of the hypothalamus,SCN)依赖的昼夜节律相关环路的调控。
文章由哈佛医学院的Clifford B. Saper课题组于2018年4月发表在Nature Neuroscience上。作者首先通过行为学发现攻击性行为受昼夜节律的影响,并且将室下区(subparaventricular zone,SPZ)的GABA能神经元敲除会打乱该种节律。由于节律本身受到SCN的控制,所以作者提出了SCNVIP→SPZGABA→VMHvl环路控制攻击性行为的节律这一假说。
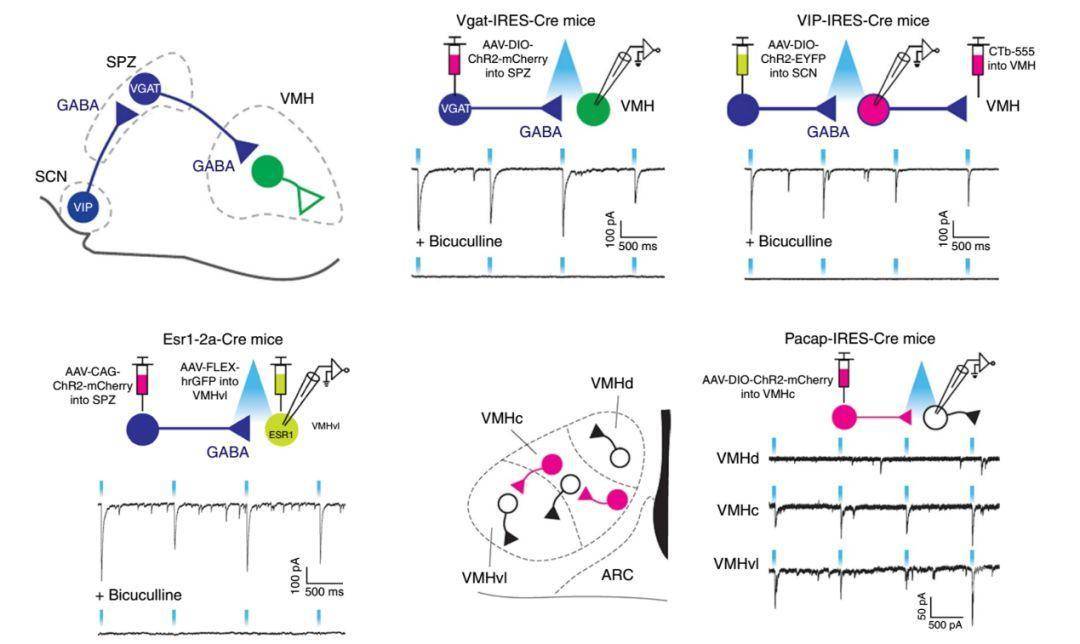
为了验证该三级环路相互调控的活动性,作者利用光遗传介导的全细胞膜片钳技术对每一个单级投射逐层验证。发现SCN的VIP神经元抑制SPZ神经元,而SPZ的GABA能神经元主要抑制VMHvl的神经元活动性。其中SPZ的GABA能神经元也有很大一部分投射到VMHc区,而通过同样的方法证实激活VMHc会引起VMHvl神经元的兴奋性突触后电流。至此,作者将整个节律介导的攻击性行为调节环路补充完整。
VTA/SNc→MeApv→BNST & VTA/SNc→MeApv→VMHdm在躲避与探索攻击的环路机制
在2019年2月,在Nature Neuroscience上发表了来自华盛顿大学的Larry S. Zweifel 课题组在研究成果,发现杏仁核内侧后腹侧区(MeApv)接受来自腹侧被盖区/黑质致密部VTA/SNc的多巴胺能神经元的投射,而自身分离成两个亚区分别投射到终末纹的床核(bed nucleus of the stria terminalis,BNST)和下丘脑腹内侧的背内侧(dorsomedial ventromedial hypothalamus,VMHdm),分别控制躲避行为和探索攻击行为。
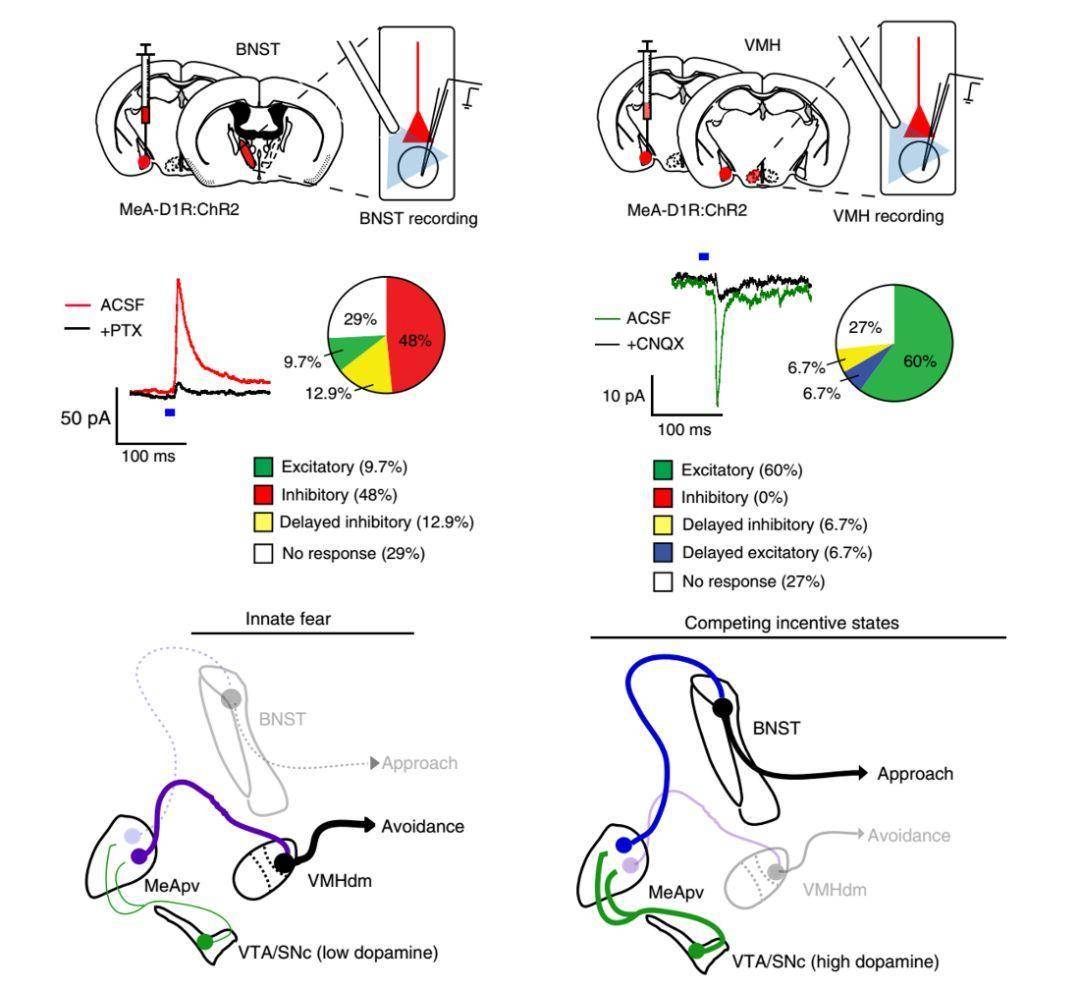
首先,研究人员证实了在MeApv存在大量的表达多巴胺D1类受体(D1R)的神经元。随后研究小组利用具有单细胞分辨率的显微钙成像技术记录小鼠在进行社会交互时的神经元响应。发现MeApv神经元分为两类,一类在躲避时被激活,另一类在探索时被激活。
通过研究发现,MeApv主要投射到BNST和VHM两个脑区,通过膜片钳记录BNST和VMH神经元发现,BNST接受抑制性输入,而VMH接受兴奋性输入。
最后,通过光遗传学分别激活或者抑制MeApv→BNST和MeApv→VMHdm两条投射通路发现其分别控制小鼠的躲避和探索攻击行为。
VTA→mPFC→dPAG调控厌恶性行为反应编码的响应强度
在2018年11月由索尔克研究所的天才科学家Kay M. Tye研究团队在Nature上发文,研究发现释放到内侧前额叶(medial prefrontal cortex, mPFC)的多巴胺能神经元可以调控mPFC→dPAG(背侧中脑导水管周围黑质, dorsal periaqueductal gray, dPAG)神经环路对厌恶行为编码的信噪比。
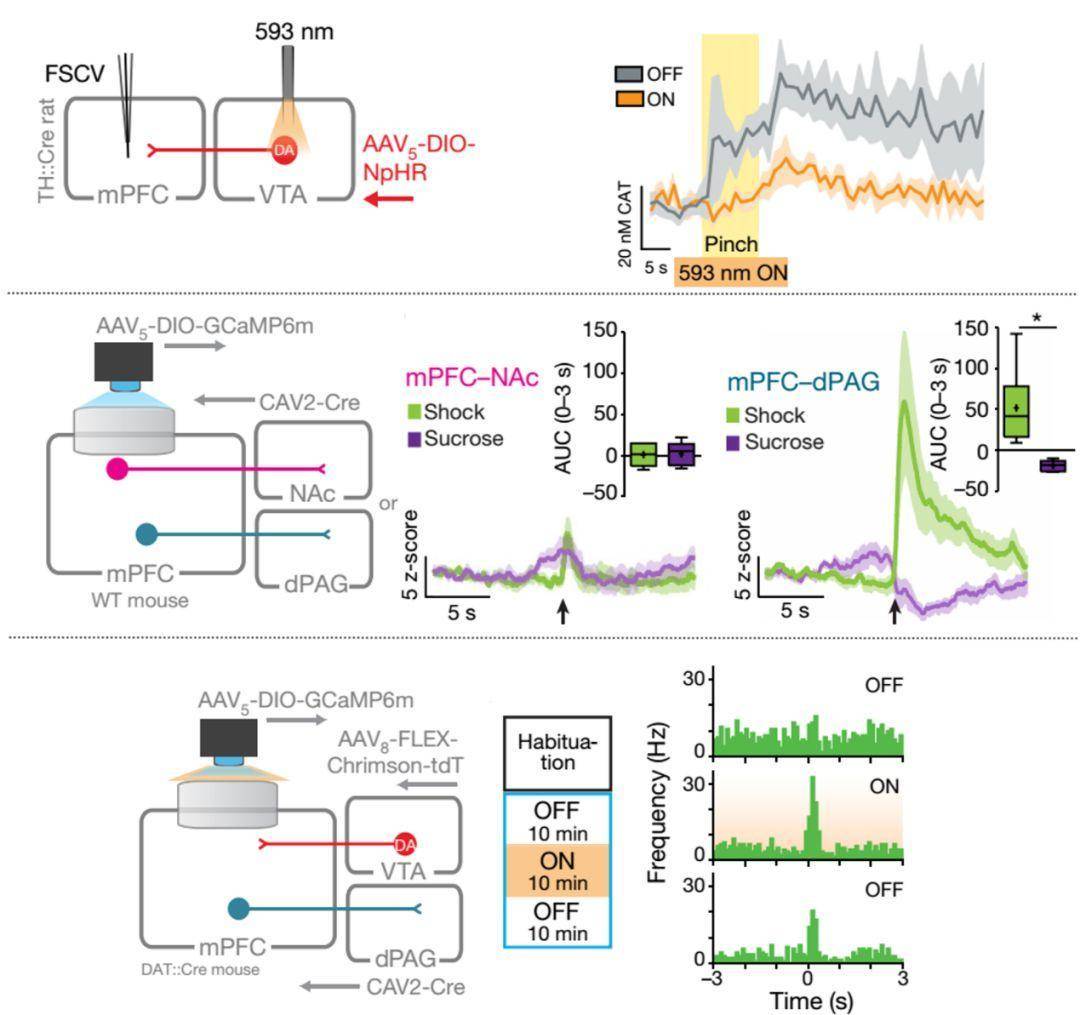
研究团队发现尾部刺激可以激发mPFC中来在腹侧被盖区(ventral tegmental area, VTA)神经元多巴胺信号的释放。抑制VTA投射到mPFC的多巴胺能神经元可以显著减少多巴胺的释放。相反激活该通路可以显著增加竞争行为中的厌恶反应。
接下来研究人员继续研究mPFC的下游投射试图找到编码厌恶性行为的投射通路。利用显微在体钙成像技术探究mPFC-dPAG和mPFC-NAc(伏状核,nucleus acumens,NAc)两条通路中mPFC神经元活动性发现,投射到dPAG的mPFC神经元特异性编码厌恶反应。
最后,研究人员利用光遗传学耦合显微钙成像技术发现激活VTA-mPFC通路上的多巴胺能神经元,促进了mPFC多巴胺的释放并显著提高投射到dPAG的mPFC神经元对厌恶性刺激反应的强度,即提高了该群神经元响应的信噪比。探究脑区之间在行为中的功能顺序连接投射是了解整个神经网络在行为下功能的基础。但想要将整个神经环路与不同行为功能进行对应还是跬步之行。
目前对三级环路的研究多是两两投射分析然后通过中间脑区进行投射串联。三级环路模式下的两两脑区之间的双向连接,正负反馈调控还有待于利用更加科学的研究方法进行全面的阐述。参考文献:1.Todd, W. D. et al. A hypothalamic circuit for the circadian control of aggression. Nat. Neurosci. 21, 717–724 (2018).2.Vander Weele, C. M. et al. Dopamine enhances signal-to-noise ratio in cortical-brainstem encoding of aversive stimuli. Nature 563, 397–401 (2018).
3.Leroy, F. et al. A circuit from hippocampal CA2 to lateral septum disinhibits social aggression. Nature (2018). doi:10.1038/s41586-018-0772-0
4.Miller, S. M., Marcotulli, D., Shen, A. & Zweifel, L. S. Divergent medial amygdala projections regulate approach – avoidance conflict behavior. Nat. Neurosci. 22, (2019).
作者信息
编译作者:Soda(brainnews创作团队)
校审:Cong and Simon(brainnews编辑部)
来源:brainnews brainnews
原文链接:https://mp.weixin.qq.com/s?__biz=MzI2ODEyOTE3OQ==&mid=2649570751&idx=1&sn=37dc6ca01a478eff4c9a8e8b06b93a14&chksm=f2eddb4bc59a525d36a04eebc2e4884b406895e3ab8c41d317459313eacb97d04e4719803a4f#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



