来源:BioArt
原标题:JEM: 章坚团队发现NLRP3炎性小体系列泛素化修饰调控机制为脓毒症治疗开发新靶点
研究表明,Nlrp3、 caspase-11及 caspase-1基因缺失可保护小鼠免于LPS诱导的内毒素血症所致死亡;且NLRP3基因多态性与脓毒症死亡率密切有关。因而,NLRP3炎性小体活性可能是内毒素血症中调控免疫反应的关键因子。但是目前NLRP3炎性小体在脓毒症中的调节机制尚未完全阐明。 Cbl-b是锌指结构E3泛素化酶,在T细胞活化、耐受诱导及T细胞分化中发挥重要作用,但有关其在固有免疫中的研究甚少。
有研究发现,抑制去泛素化酶BRCC3可导致NLRP3发生多聚泛素化,提示泛素化是调节NLRP3炎性小体活性的主要机制之一。而参与NLRP3炎性体活化过程中的具体E3泛素酶及NLRP3泛素化的生物相关性目前尚不明确。
近日,美国爱荷华大学章坚教授团队在Journal of experimental medicine上发表题为Sequential ubiquitination of NLRP3 by RNF125 and Cbl-b limits inflammasomeactivation and endotoxemia的文章,该研究揭示RNF125及 Cbl-b介导NLRP3发生次序性K63及K48位多聚泛素化,进而抑制NLRP3活性。该发现阐明了NLRP3炎性小体的新型调控机制,并提示RNF-125及Cbl-b是NLRP3炎性小体介导的内毒素血症的潜在药物干预靶点。 
在本文中,研究团队首先阐明Cbl-b特异性抑制小鼠骨髓来源巨噬细胞(BMDMs)中经典及非经典NLRP3炎性小体激动剂诱导的IL-1β释放,而并不抑制TLRs信号通路;并在人来源的巨噬细胞中进一步得到验证。在腹腔注射LPS(5 mg/kg)及盲肠结扎穿刺诱导的内毒素血症模型中,Cbl-b基因缺失小鼠更易致死。

在本文中,研究团队首先阐明Cbl-b特异性抑制小鼠骨髓来源巨噬细胞(BMDMs)中经典及非经典NLRP3炎性小体激动剂诱导的IL-1β释放,而并不抑制TLRs信号通路;并在人来源的巨噬细胞中进一步得到验证。在腹腔注射LPS(5 mg/kg)及盲肠结扎穿刺诱导的内毒素血症模型中,Cbl-b基因缺失小鼠更易致死。
进一步研究表明,异常增加的IL-1β及随后增加的TNF-α而非细胞焦亡是导致Cblb−/−小鼠死亡的主要原因,而引入NLRP3和 caspase-11基因缺失小鼠或预先使用IL-1受体抑制剂或抗TNF-α中和性抗体可阻断亚致死量LPS所致Cblb−/−小鼠的死亡。caspase-11−/−而非Nlrp3−/−能拯救致死量LPS所致Cblb−/−小鼠的死亡。
研究人员在体外实验中同样发现,caspase-11−/−而非Nlrp3−/−能下调大肠埃希菌(EHEC)诱导的野生型及Cblb−/−小鼠BMDMs细胞焦亡的发生。实验研究者随后构建了Rag-1−/−Cblb−/−小鼠,结果显示其与Cblb−/−小鼠一样对亚致死量LPS高度易感,提示固有细胞中Cbl-b基因缺失是导致LPS诱导的内毒素血症中小鼠死亡的原因。研究者通过构建条件敲除小鼠进一步证实髓系细胞中Cbl-b是调控内毒素血症的重要分子。
总的来说,研究数据显示LPS诱导的内毒素血症可活化经典及非经典炎性小体通路,而Cbl-b主要调控IL-1β的释放,且固有免疫细胞中Cbl-b表达是抑制LPS诱导的内毒素血症的关键因素。 在分子机制研究中,研究人员首先发现Cbl-b UBA结构域与NLRP3 LRR结构域相结合,提示Cbl-b结合在连接在NLRP3 LRR结构域的泛素链上。为证实这一想法,作者构建了LRR突变体(11个赖氨酸突变成精氨酸),结果显示突变体阻断了Cbl-b与NLRP3的相互作用。而Nlrp3−/−小鼠的BMDM细胞用NLRP3 K/R突变体重构可导致LPS及ATP刺激下IL-1β产生增加。Cbl-b基因失活时ATP或EHEC刺激下NLRP3降解被抑制,提示结合于NLRP3蛋白LRR结构域泛素链的Cbl-b在NLRP3发生的蛋白酶体降解中发挥重要作用。
通过GST-NLRP3、质谱分析及免疫共沉淀等实验,他们鉴定出RNF125是介导NLRP3蛋白 LRR结构域发生K63位泛素化的E3泛素连接酶,并通过UBA结构域招募Cbl-b,进而在NLRP3的NBD结构域K496位点发生K48位多聚泛素化和随后的蛋白酶体降解。 综上,研究者首次发现两种E3泛素连接酶RNF125及Cbl-b介导的新型次序性泛素化过程,进而调控NLRP3炎性小体活性,最终抑制内毒素血症及脓毒症的发生、发展。
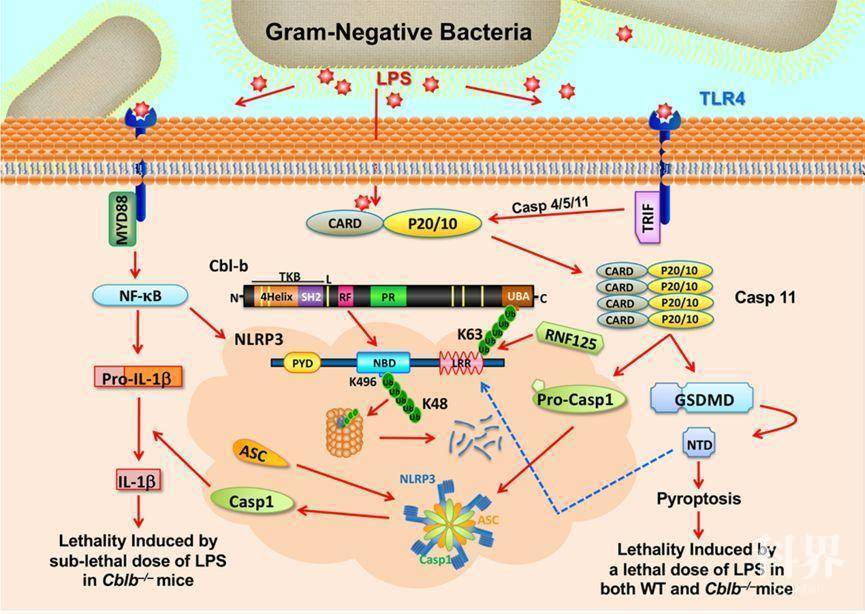 RNF125及Cbl-b调控LPS诱导的内毒素血症模式图
RNF125及Cbl-b调控LPS诱导的内毒素血症模式图
据悉,中南大学湘雅医院唐娟博士和涂莎博士为并列第一作者,为章坚教授课题组的访问学者。章坚教授和唐娟博士为论文共同通讯作者。
 RNF125及Cbl-b调控LPS诱导的内毒素血症模式图
RNF125及Cbl-b调控LPS诱导的内毒素血症模式图据悉,中南大学湘雅医院唐娟博士和涂莎博士为并列第一作者,为章坚教授课题组的访问学者。章坚教授和唐娟博士为论文共同通讯作者。
原文链接:https://doi.org/10.1084/jem.20182091
来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652481488&idx=6&sn=074a4457743ad206a326098584adfe21&chksm=84e23464b395bd722ee26e60f0360a4345e8aaae4d6f7478804331558dc61f52bd9ed9e41114#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



