来源:BioArt
责编丨雪月目前的流感疫苗必须每年进行更新,以应对流感病毒的血凝素(HA)和神经氨酸酶(NA)基因的不断突变,因为疫苗主要诱导针对这些表面抗原的中和抗体。即使每年的疫苗都会进行更新,但通常疫苗的病毒株和流行株之间的HA和/或NA抗原性不匹配,导致流感疫苗效率低或无效。因此,研究“通用”流感疫苗可以保护人们免受多种流感病毒的威胁,该类研究已经投入了大量的资源,但是至今没有一种可以通过人体临床试验。

Ⅰ型干扰素(IFN-Ⅰs)是免疫系统对抗病毒感染的主要免疫介质,可被流感病毒感染肺泡上皮细胞(Alveolar epithelial cells,AECs)和免疫细胞所强烈诱导。因此,这两种细胞中干扰素基因刺激因子(Stimulatorof interferon genes,STING)的激活可能概括了病毒感染或复制疫苗引起的免疫应答。然而,向AECs的细胞质中注入STING激动剂仍然是一个巨大的挑战,因为肺泡表面活性物质(Pulmonary surfactant,PS)层形成了一个强大的屏障,阻止纳米颗粒和亲水分子接近它们。
为了解决这一挑战,研究团队将一种天然而有效的STING激动剂cGAMP,包装入基于PS成分的脂质体,形成仿生纳米颗粒PS-GAMP。PS-GAMP与肺特异性表面活性蛋白-A (Surfactantprotein A,SP-A)和表面活性蛋白-D(SP-D)结合,并通过SP-A或SP-D介导的内吞作用协同进入肺泡巨噬细胞(Alveolarmacrophages,AMs),由于其与肺表面活性物质相似,PS-GAMP的包载物被释放到胞质中,随后通过缝隙连接从AMs流入AECs。PS-GAMP伪装成“自我”,鼻内免疫后逃脱了免疫监测,在不破坏PS和肺泡上皮屏障的情况下,激活AMs和AECs中的STING信号通路。通过这一机制,PS-GAMP避免了病毒感染引起的免疫病理反应,诱导产生了大量的Ⅰ型免疫介质,并在时间和强度上显著增强了CD11b+树突状细胞(DCs)和CD8+ T细胞的募集和分化以及体液免疫反应,进而增强疫苗交叉防护效果。这些反应主要表现在,将该佐剂与灭活的H1N1疫苗联合使用,可在单次免疫后2天内产生广谱交叉保护效果,抵抗不同型的H1N1和异型的H3N2、H5N1及H7N9病毒。这种交叉保护至少可持续6个月,并产生了持久的肺CD8+ TRM细胞。不仅在小鼠疫苗模型上有效,美国食品和药物管理局批准的雪貂模型也证明了其有效性。当AECs中缺少敲除sting或给小鼠使用缝隙连接抑制剂时,PS-GAMP介导的佐剂调节作用则在体内被消除。
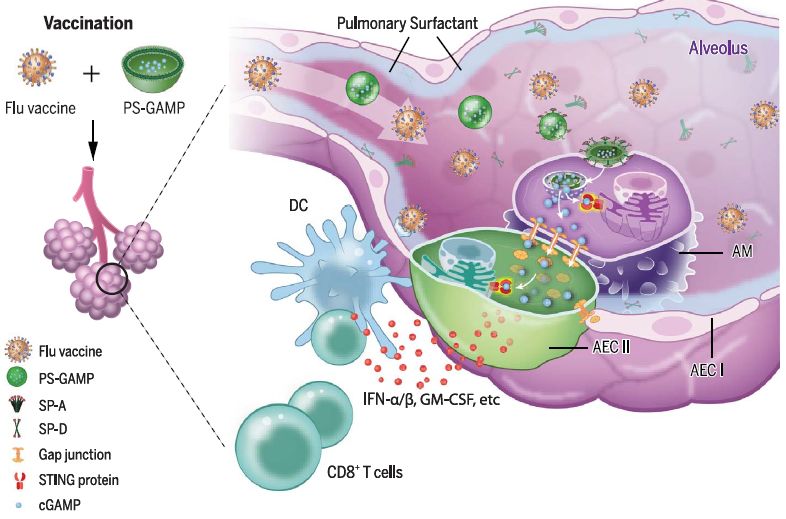
图1. PS-GAMP介导的佐剂作用。
在肺泡中,PS-GAMP与SP-A或SP-D结合并凭借其介导的内吞作用进入AMs。PS-GAMP中的cGAMP随后被释放到细胞质中,并通过缝隙连接流入AECs,然后激活这些细胞中的STING信号通路,诱导产生大量的1型免疫介质。这些介质促进了CD11b+树突状细胞的募集和分化,进而介导抗病毒CD8+ T细胞和体液免疫应答。
这项研究阐明了AECs在产生广泛的交叉保护以抵御各种流感病毒方面的关键作用,提示本文中的仿生纳米颗粒PS-GAMP可能是一种“通用”流感疫苗的潜在粘膜佐剂。鉴于此,Susanne Herold和Leif-Erik Sander还对本文的内容发表了题为“Toward a universal flu vaccine”精彩亮点评述,阐述了本研究在疫苗佐剂研究领域中的积极重要意义。
据悉,复旦大学陆路研究员及姜世勃教授团队长期致力于我国新发再发传染性疾病药物、疫苗研究,Mei X Wu教授团队专注于仿生递送系统研究,这项成果由两个团队通力合作完成。哈佛医学院麻省总医院及中山大学王骥博士、复旦大学基础医学院李佩玉博士(已毕业)、哈佛医学院麻省总医院于洋博士后为该本文的共同第一作者,哈佛医学院麻省总医院Mei X Wu副教授、复旦大学基础医学院陆路研究员为本文的共同通讯作者。
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652481337&idx=2&sn=b33425f224b618f892112ca5436e0316&chksm=84e2348db395bd9ba5b921b76eb1400e29cdcc498358037e426b785b9d8480ec803e586d988d&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



