来源:BioArt
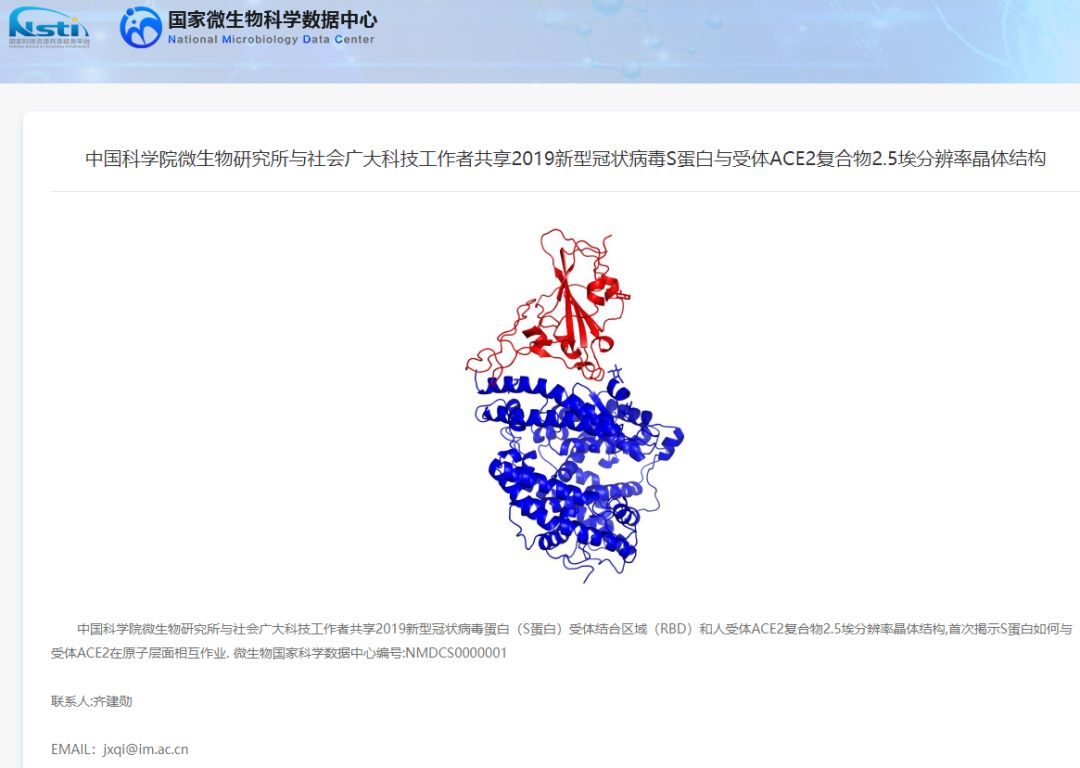
数小时之前,中国科学院微生物研究所在国家微生物科学数据中心与社会广大科技工作者共享了2019新型冠状病毒蛋白(S蛋白)受体结合区域(RBD)和人受体ACE2复合物2.5埃分辨率晶体结构,首次揭示S蛋白如何与受体ACE2在原子层面相互作用. 微生物国家科学数据中心编号:NMDCS0000001。
冠状病毒(Coronaviruses,CoV)属于尼多病毒目冠状病毒科,为有包膜的单股、正链RNA病毒,分为α,β和γ三个属。冠状病毒粒子呈球形或不规则形,有囊膜,大小为80-120 nm。其基因组的5'端带有帽子结构,其后包含6-10个开放阅读框(Open reading frames,ORFs)。占据基因组2/3的第一个阅读框编码复制酶,基因组的另1/3主要编码结构蛋白,一般包括纤突蛋白(spike,S)、小包膜蛋白(envelope,E)、囊膜蛋白(membrance,M)、核蛋白(nucleocapsid,N)。E蛋白和M蛋白主要参与病毒的装配过程,N蛋白包裹基因组形成核蛋白复合体,
冠状病毒主要通过刺突糖蛋白(Spike glycoprotein, S glycoprotein)与宿主细胞受体结合介导病毒的入侵并决定病毒组织或宿主嗜性。刺突糖蛋白(S蛋白)是一类很大的三聚体跨膜糖蛋白,其在病毒表面形成特殊的花冠结构,冠状病毒因此而得名。S蛋白可识别宿主细胞受体并介导膜融合,对于病毒颗粒进入细胞至关重要,是病毒感染宿主细胞的关键因子。2019-nCoV和2003年的SARS病毒一样,都是通过识别人类宿主的ACE2蛋白从而进入细胞的,尤其是,S蛋白结构域的细胞受体结合区(Receptor binding domain,RBD)直接参与了宿主受体的识别,该区域的氨基酸变异会导致病毒的种属嗜性和感染特性的变化。因此,获取2019-nCoV的S蛋白与ACE2蛋白的复合物结构,将有助于理解新冠病毒对比SARS病毒与ACE2结合的差异,以及2019-nCoV 的S蛋白与ACE2 结合时的存在状态,因此,2019-nCoV的S蛋白与ACE2蛋白的复合物结构为进一步精确地疫苗设计以及抗病毒药物的发现提供了重要的结构生物学基础。
此前,美国德克萨斯大学奥斯汀分校Jason S. McLellan研究组在Science杂志正式发表文章,他们利用冷冻电镜技术分析了2019-nCoV表面S蛋白的近原子结构(Science率先发布新冠病毒刺突蛋白电镜结构)。于此同时,西湖大学周强实验室利用冷冻电镜技术成功解析此次新冠病毒的受体ACE2的全长结构,这是世界上首次解析出ACE2的全长结构。然而,虽然曾有研究解析出ACE2的一个胞外结构域与SARS病毒S蛋白形成的复合物的三维结构,但2019-nCoV的S蛋白与ACE2蛋白的复合物结构至今尚未被报道。ACE2到底在细胞膜上是以什么状态存在?新冠病毒对比SARS病毒与ACE2结合有何异同?获取ACE2的全长蛋白及其与S蛋白的复合物结构,将大大有助于解答上述疑问。
2020年2月20日,中国科学院微生物研究所在线共享了2019新型冠状病毒蛋白(S蛋白)受体结合区域(RBD)和人受体ACE2复合物2.5埃分辨率晶体结构。这是研究者首次揭示2019-CoV的S蛋白如何与受体ACE2在原子层面相互作用(微生物国家科学数据中心编号:NMDCS0000001)。
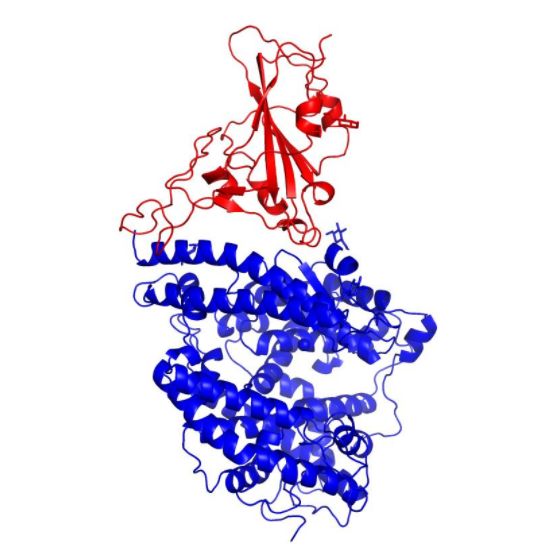
值得一提的是,2020年2月18日,清华大学生命学院王新泉课题组和医学院张林琦课题组紧密合作,利用X射线衍射技术,解析了新型冠状病毒(2019-nCoV)表面刺突糖蛋白受体结合区(receptor-binding domain, RBD)与人受体ACE2蛋白复合物的晶体结构,准确定位出新冠病毒RBD和受体ACE2的相互作用位点,阐明了新冠病毒刺突糖蛋白介导细胞侵染的结构基础及分子机制,从而为治疗性抗体药物开发以及疫苗的设计奠定了坚实的基础。这一重要研究成果已经投稿预印版平台bioRxiv。
另据悉,西湖大学周强教授团队成功解析出细胞表面受体ACE2全长蛋白与新冠病毒RBD的复合物的电镜结构,相关结果发布在印版平台bioRxiv。三个独立团队都选择在第一时间将其复合物的原子坐标向全社会公布,以提高其可能的利用率。
总体而言,ACE2全长结构的解析,将有助于理解冠状病毒进入靶细胞的结构基础和功能特征,对发现和优化阻断进入细胞的抑制剂有重要作用这一研究发现为进一步解析全长ACE2和新冠病毒的S蛋白复合物的三维结构奠定了基础。而这个工作本身为理解新冠病毒侵染细胞提供了很多有趣的线索。比如,ACE2的二聚体与新冠病毒S蛋白的三聚体是否可以发生更高层级的交联,从而促进病毒与宿主细胞膜的融合或者内吞?
另外作者们通过生物物理以及结构方面的证据发现,SARS-CoV-2的S蛋白结合人体ACE2(宿主细胞受体血管紧张素转化酶2)的亲和力要远高于SARS-CoV的S蛋白,解释了新型冠状病毒传染性之强的主要原因。
来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652481293&idx=2&sn=bd01f20ca5c4315ebf9e79bf6561e896&chksm=84e234b9b395bdaf6988f77666bf0732704b1776474c2c47e22f835591c9fa67c27fa7656fbf#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn