来源:药学进展
专家介绍:张玉彬

博士,中国药科大学生命科学与技术学院教授、博士生导师,生物化学教研室主任。担任中国生化与分子生物学学会教学专业委员会理事;江苏省生化与分子生物学学会理事;美国科学促进会(AAAS)会员;北美肥胖症研究协会(NAASO)会员;《中国药科大学学报》、《中国医药生物技术》编委。2009和2010年分别获江苏省六大人才高峰和南京市优秀留学回国人员项目资助。主要研究方向为代谢性疾病的基础与药物治疗研究。先后主持国家级科研项目4项,省部级科研项目3项,重点实验室开放基金3项。参与国家自然科学1项,参与国家863项目1项。发表研究论文、专利和编著等100多篇,独立编著学术著作1部,主编教材1部,副主编教材4部。
正文
对乙酰氨基酚损伤肝线粒体造成肝衰竭的分子机制及应用
[摘要]对乙酰氨基酚是临床上常用的解热镇痛药,但也是造成药物性肝损伤最多的药物。目前认为对乙酰氨基酚导致肝损伤的机制涉及氧化应激、线粒体损伤、炎症等多个方面。已有研究显示线粒体是对乙酰氨基酚造成肝损伤的重要靶点,从线粒体损伤出发,结合代谢与免疫阐述对乙酰氨基酚通过代谢产物破坏线粒体结构和功能并激活肝脏免疫应答造成肝脏受损的分子机制,并以抗氧化和修复损伤线粒体为基础,探讨对乙酰氨基酚肝毒性的潜在治疗方法。
对乙酰氨基酚(acetaminophen,APAP)又名扑热息痛,是一种常用的解热镇痛药,自1955年应用于临床后就成为欧洲最受欢迎的解热镇痛药,并一直占据解热镇痛药原料药市场的主导地位,以单组分或复方的形式被应用到多种治疗感冒、发热和缓解疼痛的药物中,全世界每年的消耗量达75000~80000吨。1966年,首次发现APAP可引起肝损伤。目前在美国,APAP已经成为引起急性肝功能衰竭最多的药物,而在我国,APAP是仅次于乙型肝炎病毒引起肝功能衰竭的重要因素。
另外,我国酒精性和非酒精性肝病发病率逐年升高,这类患者肝脏氧化还原平衡遭到破坏,对APAP的耐受降低,亦增加服食APAP患者用药风险。除此之外,Gong等研究发现,肠道微生物比例的昼夜差异可导致微生物代谢产物——1苯基1,2丙二酮(1phenyl1,2propanedione,PPD)在夜间含量升高,而PPD转运至肝脏会消耗肝脏谷胱甘肽(glutathione,GSH),导致相同剂量的APAP在夜间引发更加严重的肝损伤,而夜间发病很容易使患者失去最佳的救治时间,因此,APAP毒性的时辰问题在临床使用中应加以关注。此外,路燕等利用美国癌症研究所(InstituteofCancerResearch,ICR)小鼠模拟APAP肝损伤时发现,相同剂量的APAP对成年的雄鼠所致的肝损伤较雌鼠严重,故APAP肝毒性的易感性和严重程度受到了多方面因素的影响,且APAP中毒早期临床表现不明显,往往导致了APAP中毒难以防治。
线粒体是真核生物进行氧化代谢产生能量的细胞器,它对氧化损伤极为敏感,缺氧、微生物毒素、各种毒物以及射线、渗透压改变等均会导致线粒体肿胀。APAP造成的肝损伤一般可分为代谢损伤阶段和炎症损伤阶段。线粒体作为APAP代谢产物的主要靶标,参与到APAP引起的代谢损伤和炎症损伤2个阶段,在代谢与免疫反应中均发挥了重要的桥梁作用。
因此,线粒体也成为“代谢免疫(immunometabolism)”这一新兴的学科分支重要的研究对象。本文主要从线粒体损伤出发,探讨APAP造成肝损伤甚至急性肝衰竭的机制以及与线粒体损伤相关的潜在治疗方案。
1对乙酰氨基酚损伤肝脏线粒体的机制
1.1线粒体与氧化应激
线粒体是一种由2层膜包被的细胞器,由外至内可划分为线粒体外膜、线粒体膜间隙、线粒体内膜和线粒体基质4个功能区,除作为细胞的“能量工厂”外,也参与细胞分化、细胞信息传递和细胞凋亡等过程,并拥有调控细胞生长和细胞周期的能力。线粒体在通过氧化磷酸化产生三磷酸腺苷(adenosinetriphosphate,ATP)时,呼吸链中传递的电子很容易从线粒体内膜漏出,与线粒体基质中的氧结合生成超氧阴离子(˙O2),再转变为羟基自由基(·OH)和过氧化氢(H2O2),这三者是细胞内最强的活性氧簇(reactiveoxygenspecies,ROS)成员。细胞内80%的ROS来自线粒体,因此,生物进化时,线粒体内保留了一套完整的ROS防御系统,如超氧化物歧化酶(superoxidedismutase,SOD)、谷胱甘肽过氧化物酶(glutathioneperoxidase,GPX)、谷胱甘肽还原酶(glutathionereductase,GRX)和谷胱甘肽(glutathione,GSH)等,这些生物分子可及时消除线粒体内产生的过量ROS,但当线粒体受损伤时,则会产生持续性高浓度的ROS,导致线粒体膜脂质和线粒体DNA氧化受损,从而引起炎症反应。
1.2对乙酰氨基酚在肝脏内的代谢
药物在肝脏进行的代谢转化一般可以分为Ⅰ相代谢反应和Ⅱ相代谢反应,Ⅰ相代谢反应包括氧化、还原、水解和去甲基化,可将药物代谢为具有肝细胞毒性的产物。Ⅱ相代谢反应为结合反应,药物或Ⅰ相代谢反应产物与葡萄糖醛酸、硫酸、谷胱甘肽等内源性物质共价结合,增强物质极性,使其易于通过尿液排出体外,即药物解毒的过程。1973年Mitchell等通过APAP动物模型揭示了APAP的代谢过程,在治疗剂量下,APAP主要通过Ⅱ相代谢途径代谢,85%~90%的APAP在葡萄糖醛酸基转移酶(glucuronictransferase,UGTs)和磺基转移酶(sulfonatetransferase,SULTs)的催化下与葡萄糖醛酸和硫酸物结合,生成无毒的代谢物,10%的APAP经肝脏细胞色素P450系统代谢,产生有毒的活性中间体N乙酰对苯醌亚胺(Nacetylpbenzoquinoneimine,NAPQI),正常量的NAPQI在谷胱甘肽硫转移酶(glutathioneStransferase,GST)的催化下能够结合谷胱甘肽产生无毒的硫醇尿酸,通过尿液排出体外,4%的APAP以其原型从尿液中排出体外。
另外,还有极小比例的APAP会被髓过氧化物酶或环氧酶1氧化。肝脏作为体内以代谢为主的器官,摄入的各类物质在影响肝脏健康状态的同时也会影响APAP的代谢。有研究显示,由于酒精也通过CYP2E1进行代谢,长期饮酒会增强CYP2E1的活性或延长其半衰期,促进细胞色素P4502E1(cytochromeP4502E1,CYP2E1)对APAP的代谢,产生更多的NAPQI,导致肝脏对APAP的耐受降低,但研究发现,急性的酒精摄入或许能够通过竞争CYP2E1来缓解APAP造成的肝损伤。因此,酒精摄入对于APAP肝损伤的影响还有待进一步探究。此外,多种食物也会影响CYP450酶活性,故在临床使用APAP的过程中应多加关注。
1.3代谢产物诱导氧化应激并破坏线粒体防御体系
APAP代谢产生过量NAPQI,在造成氧化应激的同时能够结合线粒体和肝脏细胞蛋白,破坏线粒体和细胞结构,损伤线粒体功能并阻碍新的线粒体生成,导致肝脏内线粒体防御体系受损。美国食品药品监督管理局(FoodandDrugAdministration,FDA)建议成人每天摄入的APAP应少于4g,超出UGTs和SULTs代谢能力的APAP主要通过细胞色素P450酶系统中CYP2E1代谢,也有少量由CYP1A2/3A4代谢,产生大量的NAPQI。线粒体是NAPQI的主要靶标,一方面过量的NAPQI通过半胱氨酸残基结合到线粒体膜蛋白上形成APAP复合物,改变线粒体膜结构,导致线粒体膜通透性增加,破坏膜电位;另一方面,NAPQI消耗大量的GSH,破坏肝脏氧化还原平衡,从而使线粒体中ROS水平升高,导致线粒体膜脂质过氧化,膜流动性降低。GSH耗竭导致未被及时清除的ROS激活cJun氨基末端激酶(c-Jun N-terminal kinase,JNK)并使其转位进入线粒体,持续激活的JNK促进线粒体不断地产生ROS,ROS和JNK的相互作用增强了线粒体氧化应激。核因子E2相关因子(nuclear factor erythroid 2-related factor-2,Nrf2)作为体内主要的抗氧化转录因子,受到刺激能够入核诱导其下游包括解毒、抗氧化以及药物代谢相关基因的表达;低剂量APAP能够激活Nrf2,使其入核诱导下游抗氧化基因的表达,发挥对肝脏的保护作用,但摄入过量的APAP会抑制Nrf2的表达,故大剂量的APAP代谢产物不仅消耗谷胱甘肽储备,同时还破坏机体抗氧化相关基因的转录,导致肝脏的抗氧化防御系统崩溃。
由于细胞中80%的ROS都来自线粒体,线粒体结构和功能的完整有助于线粒体固有的ROS防御系统发挥作用,但张廷芬等研究发现,低浓度的APAP会影响线粒体的呼吸功能,且由ROS激活的JNK亦能结合到线粒体,通过下调丙酮酸脱氢酶的活性,从而降低线粒体代谢。BarbierTorres等也发现,APAP中毒患者体内内源性线粒体负性调节因子——MCJ的水平显著升高,MCJ是一种定位于线粒体内膜的跨膜蛋白,可与线粒体呼吸链复合物Ⅰ相互作用,从而降低其活性,APAP能够通过MCJ干扰线粒体呼吸复合物的形成,在减少ATP合成的同时增加ROS的生成。
另外,过量APAP代谢产生的NAPQI能够选择性地抑制线粒体复合物Ⅱ的正常功能,同时NAPQI能够与ATP合酶的α亚基结合,破坏其生物活性,使ATP合成受损。APAP在体内由3'磷酸腺苷5'磷酸硫酸作为硫酸的供体,在葡萄糖醛酸基转移酶的催化下代谢为无毒的产物排出体外。由于3'磷酸腺苷5'磷酸硫酸是由含硫氨基酸提供硫酸基团并与ATP反应生成,ATP合成受损可能会减弱SULTs对APAP的代谢,导致更多的APAP经CYP2E1代谢,从而放大NAPQI对线粒体的氧化损伤。
在正常生理状态下,过氧化物酶体增殖物激活受体γ共激活因子1α(peroxisome proliferator activated receptor-γ coactivator 1α,PGC1α)作为促进线粒体生成的主要调节因子,能够调控线粒体的数量与形态。
研究显示,乙酰肉毒碱能够通过PGC1α调控线粒体生成。张廷芬等研究发现,低浓度的APAP能够诱导PGC1α的表达,同时也促进核呼吸因子1/2(nuclear respiratory factor1/2,NRF1/2)以及下游线粒体转录因子A(mitochondrial transcription factor A,MTFA)的表达,进而抵抗线粒体损伤,缓解APAP造成的肝损伤,但高浓度的APAP会抑制PGC1α、NRF1/2和MTFA的表达,减少线粒体生成,表明APAP通过代谢活性中间产物NAPQI,不仅能够消耗GSH,造成氧化应激,破坏线粒体的结构和功能,亦能阻碍线粒体的生成,导致肝细胞线粒体数量和功能异常。
1.4代谢产物通过线粒体介导肝脏炎症损伤
肝脏作为体内固有免疫的主要器官之一,不仅含有大量的内源性巨噬细胞,即枯否细胞(Kupffercells,KCs),且能够快速募集循环系统的淋巴细胞进入肝脏发挥免疫作用。Nod样受体蛋白3(Nod like recepte rprotein 3,NLRP3)炎性小体的激活能控制促炎因子白细胞介素1β/18(interleukin1β/18,IL1β/18)的成熟和分泌,其活化依赖于“启动”和“激活”2个功能不同的步骤。Zhong等在研究炎症小体NLRP3激活的过程中发现,损伤线粒体生成的ROS能氧化线粒体DNA(mitochondriaDNA,mtDNA)生成氧化型mtDNA(OxmtDNA),OxmtDNA可结合并激活NLRP3,促进半胱氨酸天冬氨酸蛋白酶1前体(procaspase1)的成熟,进而切割白细胞介素1β/18前体(prointerleukin1β/18,proIL1β/18),使其成熟并释放到胞外发挥免疫作用;另外,激活Toll样受体4/9(Tolllikereceptor4/9,TLR4/9)信号产生proIL1β和proIL18的同时能够通过髓样分化因子(myeloid differentiation factor88,MyD88)和β干扰素TIR结构域衔接蛋白(TIR-domain-containing adapter inducing interferon-β,TRIF)激活干扰素调节因子(interferon regulatory factor1,IRF1)依赖的胞苷单磷酸激酶2(cytidine/uridine monophosphate kinase2,CMPK2)转录,增加mtDNA的合成,促进由NLRP3介导的免疫反应。
在APAP中毒破坏肝脏的过程中,活性代谢产物NAPQI既能消耗GSH,提高肝脏内ROS的水平,亦能与线粒体蛋白结合,破坏线粒体导致线粒体DNA释放,机体免疫系统能够通过TLR9识别mtDNA并使其激活,同时释放包括凋亡诱导因子(apoptosis inducing factor,AIF)和核酸内切酶G(endonuclease G,EndoG)在内的间质蛋白,并转移至核内,从而使DNA发生碎片化,导致mtDNA、ATP、DNA碎片等细胞内容物作为损伤相关分子模式(damage associated molecular patterns,DAMPs),刺激KCs,为NLRP3活化的启动和激活阶段提供条件,最终导致固有免疫反应和适应性免疫反应的发生。一般认为,激活KCs能够加剧APAP导致的肝损伤,但免疫反应亦能够通过清除坏死细胞促进肝脏的修复,因此免疫反应能在肝脏中发挥损伤和修复的双重功能,但持续和过量的炎症反应会加剧肝细胞的损伤和坏死。
2缓解肝线粒体损伤的药物研究
2.1抗氧化药物
2.1.1N乙酰半胱氨酸在目前的临床治疗中,N乙酰半胱氨酸(Nacetylcysteine,NAC)是对APAP中毒具有明确疗效的解毒剂,可以用于所有APAP过量中毒的患者。NAC进入细胞后,可脱去乙酰基生成L半胱氨酸,L半胱氨酸是GSH的合成前体,能够与甘氨酸和谷氨酸结合生成GSH,同时NAC中含有巯基,是GSH的活性基团,易被氧化脱氢,能够代替GSH与APAP的代谢物NAPQI共价结合,从而发挥直接解毒作用;另外NAC能提供合成磺酸基的原料,磺酸基能与APAP结合而解毒。但NAC一般用于疾病发生的早期,在过量服用APAP后的10~12h内能阻止肝损伤的发生,但对于无意识服用大量APAP的患者以及中毒晚期患者治疗效果有限。然而,也有文献报道,在疾病发展后期,NAC可能通过提高NO的产生,改善肝脏灌注和供氧,同时清除活性氧和活性氮,改善线粒体的能量供应,从而降低APAP急性肝衰竭患者的死亡率。
2.1.2天然活性物质氧化应激为APAP导致肝损伤的重要环节,已有大量文献报道具有抗炎和抗氧化能力的天然提取物能够预防APAP导致的急性肝损伤(见表1)。
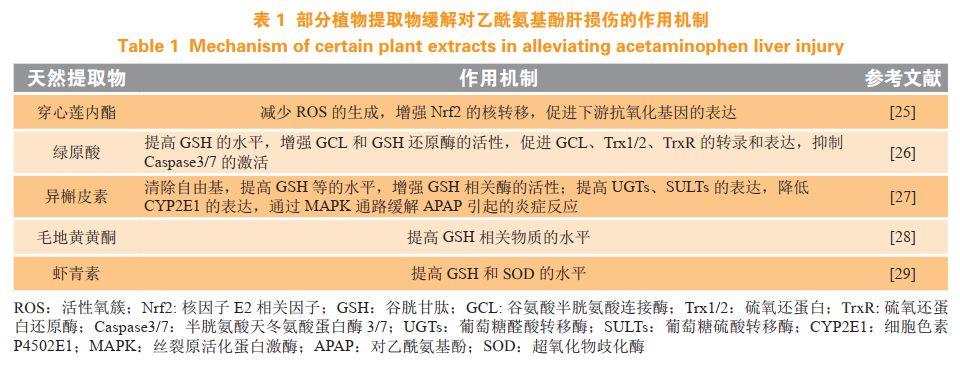
然而,值得注意的是,有关天然活性物质的研究仍停留在预防阶段,且Salminen等研究显示,在灌胃给予小鼠150mg·kg1的APAP6h后再给予小鼠绿茶提取物加重了APAP导致的肝毒性,因此具有抗氧化活性的天然提取物对APAP肝毒性的治疗效果仍需进一步研究。
2.2靶向线粒体缓解对乙酰氨基酚肝毒性
APAP中毒可导致线粒体功能受损,利用电子传递链复合物以及相关酶的类似物能够修复线粒体功能,缓解APAP导致的肝损伤。四甲基哌啶氮氧化物(2,2,6,6tetramethyl1piperidinyloxy,TEMPO)可以作为SOD的类似物,通过与亲脂性的三苯基膦离子结合靶向进入线粒体,从而改善线粒体抗氧化的功能。Du等给予C57BL/6J小鼠腹腔注射300mg·kg1的APAP,1.5h后给予线粒体靶向抗氧化剂——MitoTEMPO(MT),发现MT能减少肝脏谷胱甘肽二硫化物以及过氧亚硝酸盐的形成,并抑制线粒体Bax的转移以及线粒体内膜蛋白(如凋亡诱导因子)的释放,抑制核DNA的片段化,进而缓解3~12h内APAP导致的肝损伤。进一步研究显示,MT在APAP中毒12h和24h后仍能够发挥保护作用,然而在MT处理的小鼠肝脏中虽未见细胞坏死,但细胞凋亡显著增加,且MT组半胱氨酸天冬氨酸蛋白酶3(Caspase3)的切割和活化显著提高,表明MT能通过调节线粒体氧化应激和受体结合丝氨酸苏氨酸激酶3(receptor binds serine threonine kinase 3,RIP3)的表达,将细胞死亡的方式由坏死转化为继发性凋亡,从而能够减少由坏死细胞释放的细胞内容物对肝细胞的损伤。
此外,亚甲蓝作为一种用于临床的解毒剂,可以通过渗透线粒体膜,作为电子传递链复合物Ⅱ的替代品,维持线粒体电子传递链稳态和线粒体生物能量平衡。Lee等研究表明,小于3μmol·L1的亚甲蓝就能够接受NAPQI的电子,恢复线粒体ATP合成速率。在正常情况下,亚甲蓝能够阻止线粒体通透性转变以及细胞内ATP的缺失。C57BL/6J小鼠在给予450mg·kg1APAP90min后腹腔注射给予10mg·kg1的亚甲蓝能够缓解APAP造成的肝损伤。并且亚甲蓝在体内被还原后能够将高铁血红蛋白还原为血红蛋白,缓解APAP造成的高铁血红蛋白血症。
目前,虽然针对线粒体修复的解毒剂能够治疗APAP中毒,其疗效甚至超过NAC,如MT与NAC联合使用的疗效较NAC单独使用更好,且利用MCJ的抑制剂能够在NAC治疗无效的情况下缓解APAP导致的肝毒性。但上述药物多处于体外研究阶段,仅能作为探索治疗APAP中毒药物的研究方向,尚不能直接用于临床。
2.3线粒体移植治疗
线粒体治疗(mitochondrial therapy,mitotherapy)是利用外源的功能性线粒体替换有功能障碍的线粒体,从而达到治疗线粒体相关疾病的目的。Shi等将从HepG2中分离得到的功能性线粒体加入到APAP造模的细胞培养基中后发现,外源线粒体能够进入到体外培养的肝原代细胞中,并能显著提高APAP处理后细胞的活力,同时还能够降低ROS的水平,增强ATP的合成,提高GSH的水平。通过静脉注射将外源的功能性线粒体注射进小鼠体内后,线粒体会分布到包括肝脏在内的多种组织中,通过这一技术,外源性的线粒体通过增加肝细胞能量供应,降低氧化应激,缓解了APAP导致的肝脏损伤,但外源性的线粒体应完整,损坏的线粒体可能会破坏肝细胞。因此,外源性线粒体在细胞和动物水平缓解APAP所导致的肝损伤为治疗因线粒体损伤导致的人肝损伤提供了一种有潜力的治疗方案,但若进入临床治疗,还有待深入。
3结语
目前,APAP是造成药物性肝损伤的主要因素,其致病过程较为复杂,且不同阶段呈现出不同的特征。虽然临床上认为常规剂量的APAP副作用较少,但由于目前超过30种在售的解热镇痛药都含有APAP且患者对APAP肝毒性的认识较少,易导致患者在无意识的情况下重复服用APAP,进而导致肝脏受损,因此在未来对APAP肝毒性的防治工作中不仅要加强对治疗药物和治疗方案的研究与开发,还需提高患者对APAP肝毒性的认识,才能从根源减少APAP导致的肝损伤。
来源:ppsyxjz 药学进展
原文链接:http://mp.weixin.qq.com/s?__biz=MzA5MDY3ODExNQ==&mid=2651308187&idx=1&sn=9fb7e6318bbad4880a8207bdd5e07307&chksm=8bf49697bc831f81e8d0b52eb304189c13d5f03e5a8389389bceb11a34f13a0a604a4308dc4a&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



