2023年5月10日,上海交通大学Bio-X研究院朱金伟课题组在Science Advances杂志在线发表题为“Phosphorylation-dependent recognition of diverse protein targets by the cryptic GK domain of MAGI MAGUKs”的研究论文,发现MAGI家族蛋白的PDZ-GK超结构域是一种新型磷酸化蛋白识别模块,该工作进一步阐释了其识别磷酸化蛋白的结构基础。
蛋白质的磷酸化/去磷酸化及其介导的蛋白复合物的组装/解离是细胞内信号转导的关键调控方式之一。在过去的几十年间,研究人员已经发现了一系列能够特异识别磷酸化蛋白(多肽)的结构模块,包括FHA、WD40、BRCT、WW等结构域。这些结构域介导的磷酸化依赖的蛋白相互作用网络在细胞动态行为中发挥重要作用。发现并阐释新型磷酸化蛋白识别机制是细胞信号转导领域的基础科学问题。
MAGUK家族蛋白是一类定位于细胞连接处的多结构域支架蛋白,在细胞粘附、细胞极性、细胞迁移、突触发育和可塑性等方面都发挥重要作用。其中,MAGI亚家族蛋白主要分布在神经突触和肾小球足细胞,主要包含PDZ、WW、GK等结构域(图1)。本项工作发现,MAGI2的GK结构域与其邻近的PDZ0结构域形成PDZ-GK超模块识别磷酸化蛋白(如磷酸化SAPAP多肽,pSAPAP)。MAGI2-pSAPAP复合物的三维结构阐释了这一磷酸化依赖的相互作用的分子机制。基于生化和结构分析,课题组确定了这一识别模式的一般规律:-R-Φ-x-S-Y-X-X-A-Ψ-。基于该保守基序,课题组鉴定出一系列全新的能够结合MAGI2的靶标蛋白,包括Ephexin4、SGEF、ARHGAP21/23、LL5A等(图1)。MAGI2-pSGEF复合物和MAGI2-pEphexin4复合物的三维结构进一步证实了该相互作用模式的普适性结构基础。课题组最后探索并验证了MAGI2-SGEF复合物在细胞骨架动态调控和细胞迁移中的全新功能。该工作综合利用生物物理学、细胞生物学、化学生物学等手段,发现并阐明了MAGI家族蛋白的PDZ-GK超模块识别磷酸化蛋白的分子机制,拓展了人们对细胞信号转导中磷酸化依赖的蛋白识别机制的认识。
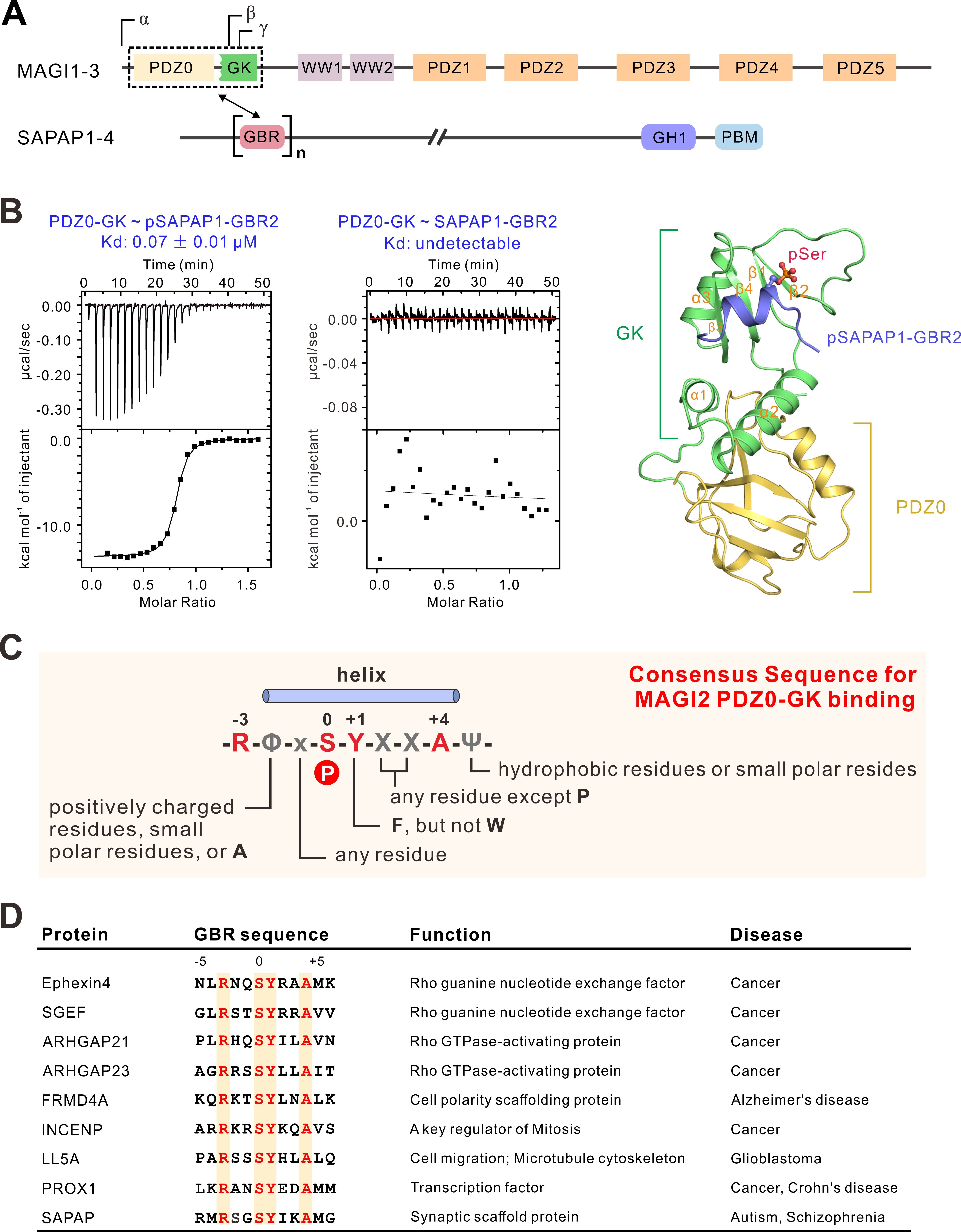
图1. MAGI家族蛋白的PDZ-GK超结构域是一种新型磷酸化蛋白识别模块
原文链接:https://www.science.org/doi/10.1126/sciadv.adf3295
设施贡献
国家蛋白质科学研究(上海)设施规模化蛋白质制备系统为用户提供等温滴定微量热仪,测量PDZ0-GK超结构域识别多肽的热力学参数变化,为该课题提供重要的相互作用数据,蛋白质晶体结构分析系统BL18U1线站及BL19U1线站为该工作的晶体衍射数据的收集提供技术支持,复合激光显微镜系统为该工作的成像实验的测试提供机时保障。
内容来源:中国科学院重大科技基础设施共享服务平台
来源:中国科学院重大科技基础设施共享服务平台
原文链接:http://lssf.cas.cn/lssf/dbzkxyjshss/xwdt/202309/t20230918_4585033.html
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn