巨噬细胞是免疫系统中不可或缺的组成部分,广泛分布在不同组织中,并在发育、器官形成、稳态维持和疾病发生发展中发挥关键作用。巨噬细胞异质性显著,主要表现在形态、定位、基因表达谱及功能等方面,这些表型由巨噬细胞的发育起源和驻留的微环境决定。具有组织特异性特征的巨噬细胞包括中枢神经系统的小胶质细胞(Microglia)、肝脏的枯否细胞(Kupffer cells)和表皮的朗格汉斯细胞(Langerhans cells)等。另有一些分布于多个器官的巨噬细胞,如血管周围巨噬细胞(Perivascular macrophages)。基于啮齿类动物的研究成果,学术界对巨噬细胞亚型的多样性、发育起源以及组织特异性的形成有了一定认识。然而,这些发现是否适用于人类仍然未知,特别是人类胚胎发育过程中巨噬细胞的多样性、发育起源、功能及成熟的动态过程等问题缺乏深入而全面的研究。
9月12日,中国科学院深圳先进技术研究院李汉杰课题组联合深圳市宝安区妇幼保健院、深圳大学、上海交通大学和复旦大学等,在《细胞》(Cell)上,发表了题为An immune cell atlas reveals the dynamics of human macrophage specification during prenatal development的研究文章。该团队结合单细胞转录组测序、先进的生物信息学手段、多重免疫荧光染色、体外功能实验等技术,构建了横跨18个发育阶段、19种组织的人类胚胎免疫系统发育高分辨率图谱。该研究重点关注最具组织特异性的巨噬细胞,鉴定了15种巨噬细胞亚型。其中,包括两种新的巨噬细胞亚型,即存在于表皮、睾丸、心脏等外周组织的类小胶质细胞(Microglia-like cells)和具有血管生成促进功能并广泛分布于多个组织中的促血管生成巨噬细胞(Proangiogenic macrophages, PraM)。该研究通过构建人类产前免疫细胞发育的时空动态图谱,揭示了多种巨噬细胞亚型在发育过程中的分化起源、空间定位、功能特征及转录调控机制。
该研究对来自受孕后4-26 PCW(Postconceptional Week,PCW)囊括19种人类胚胎组织样本的免疫细胞进行了单细胞转录组测序,获得了近30万个高质量的免疫细胞(图1),并鉴定了11种主要的免疫细胞类型,包括巨噬细胞(Macrophages)、祖细胞(Progenitor cells)、B 淋巴细胞、T 淋巴细胞、先天淋巴细胞(Innate-like lymphocytes)、自然杀伤细胞(Natural killer cells)、树突状细胞(Dendritic cells)、单核细胞(Monocytes)、巨核细胞(Megakaryocytes)、粒细胞(Granulocytes)和红细胞(Erythrocytes)。在此基础之上,研究对每一种主要的免疫细胞类型进行了更细致的分类,最终注释得到56种免疫细胞亚型。
科研人员重点对巨噬细胞开展研究并将其进一步细分为15个亚群。通过时空分析,研究发现在人类胚胎发育时期,巨噬细胞便已具有显著的组织特异性。在4 PCW左右(器官初形成阶段),巨噬细胞前体已出现在胚胎以及卵黄囊中并一直持续到大概8 PCW,直到被成熟的组织驻留巨噬细胞所替代。在这些巨噬细胞中,一部分亚型具有显著的组织特异性特征,如中枢神经系统中的小胶质细胞、肝脏中的枯否细胞、表皮中的朗格汉斯细胞等。而另一部分亚型共享于多个组织中,如促血管生成巨噬细胞以及其前体细胞(pre-Proangiogenic macrophages, pre-PraM)。研究还发现,肾上腺中有一群特有的组织驻留巨噬细胞(AXL+、FCGR3A+),睾丸中也存在一群特有的组织驻留巨噬细胞(MMP9+)和一群具有破骨细胞特征的巨噬细胞(ACP9+、SIGLEC15+、MMP9+)。
本研究首次在胚胎多个外周组织(皮肤、心脏及睾丸)中鉴定出一群与小胶质细胞有相似基因表达谱特征的巨噬细胞。这一发现打破了小胶质细胞只存在于脑及脊髓中的传统认知。这群细胞高表达P2RY12、TMEM119、SALL1、C3等与小胶质细胞相同的特征基因,在无监督聚类分析中,这群细胞和脑、脊髓中的小胶质细胞聚为一类。因此,研究将这群新发现的分布在多个外周组织的细胞命名为类小胶质细胞(Microglia-like cells)。流式分析进一步验证了这群外周组织中的类小胶质细胞与中枢神经系统中的小胶质细胞一样,均呈现CD45lowP2RY12+MRC1-的表型。此外,研究基于多重免疫荧光实验发现,类小胶质细胞在Carnegie Stages 12(CS12)时期已出现在表皮组织中。在14 PCW之前,类小胶质细胞一直是表皮中最主要的免疫细胞,此后细胞比例才开始逐渐减少,在20 PCW之后,基本被朗格汉斯细胞替代。在胚胎心脏中,类小胶质细胞最早出现在CS13的主动脉(aorta)中,并在26 PCW之前一直是主动脉中最主要的免疫细胞。而成人主动脉组织中则检测不到这群类小胶质细胞。在胚胎睾丸中,类小胶质细胞最早能够在CS14的时候被检测到,主要存在于附睾(epididymis)中的输出小管(efferent duct)周围,而在睾丸实质(parenchyma)中比例则较低。
研究显示,表皮和中枢神经系统均起源于外胚层,而主动脉和附睾则起源于主动脉-性腺-中肾(aorta-gonad-mesonephro,AGM)区域。研究推测,小胶质细胞以及类小胶质细胞的前体从卵黄囊迁移到外胚层和AGM区域,而后在这两个区域独立分化为小胶质细胞或类小胶质细胞。
由于类小胶质细胞在表皮中最为丰富,该团队进一步研究了它们在表皮组织中的功能。研究发现,与四肢和腹部皮肤相比,类小胶质细胞在背部和头部表皮中比例更高。在9 PCW时,背部表皮中几乎所有的免疫细胞均是类小胶质细胞,而四肢表皮中约60%的免疫细胞是类小胶质细胞。进一步定量分析表明,在胚胎发育不同阶段,背部表皮的类小胶质细胞都比四肢表皮更多,分布更密集。
类小胶质细胞在表皮中的极化分布模式与神经嵴细胞(neural crest cells,NCCs)的背外侧迁移路线(dorsolateral migration)有类似之处,因而研究推测表皮的类小胶质细胞与NCCs之间可能存在某种互作。NCCs是外胚层衍生的多能干细胞,背外侧迁移时可分化为黑色素细胞(melanocytes)。研究通过多重免疫荧光实验发现,表皮中的类小胶质细胞和NCCs之间存在直接的相互作用。与之一致的是,该团队观察到类小胶质细胞和黑色素母细胞(melanoblasts)的密度在不同发育阶段沿表皮的背-侧-腹轴(dorsal-lateral-ventral axis)逐渐降低。
为了评估类小胶质细胞对神经嵴细胞分化的影响,该研究体外培养了来源于胚胎背部的新鲜皮肤组织块。在胚胎皮肤中清除类小胶质细胞显著减少了黑色素母细胞的数量,这提示类小胶质细胞可能会调控神经嵴细胞向黑色素细胞的分化。
该研究在多个脏器中都鉴定到一群高表达促血管生成基因(VEGFA、TNF、IL1B、CXCL8/IL8)的巨噬细胞。同时,这群细胞在不同组织中均具有相似的基因表达谱。体外成管实验也证实了这群细胞促血管生成的功能。进一步,分析发现,这群细胞在各个脏器中均富集在血管周围。
研究进一步分析了这群促血管生成巨噬细胞的发育起源。科研人员通过多种拟时序分析算法推断这群细胞是从卵黄囊起源的巨噬细胞前体分化而来,且中间经历了一个相对不成熟的前体状态(pre-PraM)。拟时序分析推算出的分化轨迹与细胞的真实采样时间高度一致,且其促血管生成信号也在随之增强。此外,研究团队采用成管的内皮细胞上清液培养来源于卵黄囊的早期巨噬细胞前体,发现可以诱导出表达促血管生成基因的巨噬细胞。上述成果明确了这群促血管生成巨噬细胞的发育起源。
总而言之,该研究通过对人类产前阶段近30万个免疫细胞的单细胞转录组分析,着重描绘了15种巨噬细胞亚型的时空动态变化。该研究突破性的发现了一群在转录组、特征蛋白表达和形态上与中枢神经系统中的小胶质细胞类似且存在于皮肤、睾丸和心脏中的类小胶质细胞。它们是早期表皮中的主要免疫细胞群,沿背-侧-腹轴呈极化分布。这群类小胶质细胞可以与神经嵴细胞相互作用,并调节其向黑色素细胞的分化。通过功能、空间特征、分化轨迹的研究,科研团队细致解析了一种尚未被充分了解的促血管生成巨噬细胞(它们驻留在多个器官的血管周围)。这些促血管生成巨噬细胞与小胶质细胞均从起源于卵黄囊的巨噬细胞前体分化而来(图2)。该成果为探讨人类巨噬细胞的异质性和发育提供了高分辨率的时空动态图谱,有助于剖析其在发育过程中的不同作用。此外,该团队开发了专门的可视化平台(http://119.8.233.169/),方便共享数据,促进研究成果的共同探索和领域发展。
论文链接
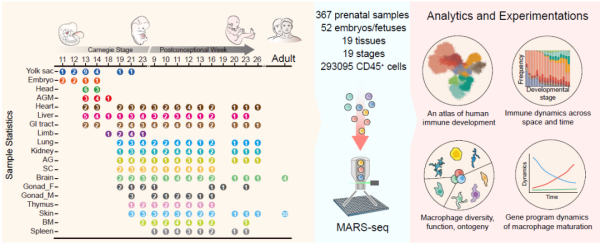
图1. 构建人类免疫系统发育时空图谱
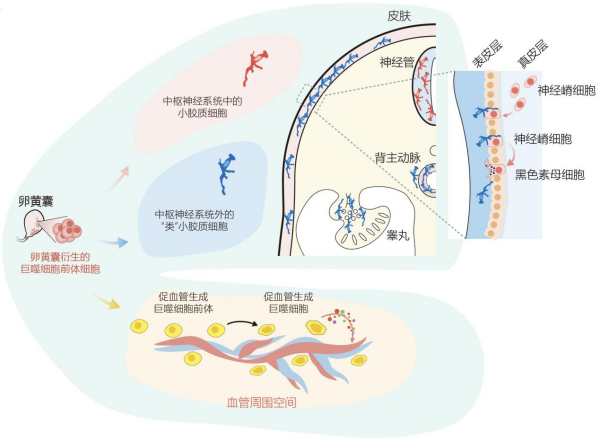
图2. 巨噬细胞前体分化为小胶质细胞/类小胶质细胞和促血管生成巨噬细胞;类小胶质细胞在表皮与神经嵴细胞互作,并调控其分化

图3. 孙悟空猴毛变出多种猴子的情节寓意卵黄囊来源的巨噬细胞前体向不同细胞亚群的分化
内容来源:中国科学院
来源:中国科学院
原文链接:http://www.cas.cn/syky/202309/t20230913_4970401.shtml
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn




