科技日报记者 王春
1月12日,记者从中国科学院上海药物研究所了解到,该所徐华强/庄友文团队联合美国北卡罗莱纳大学教堂山分校Bryan L. Roth团队系统地分析各内源性阿片肽对阿片受体的信号活性,解析了阿片受体家族四个亚型和各自的选择性阿片肽包括内啡肽、内吗啡肽、强啡肽、皮啡肽和痛敏肽的冷冻电镜复合物结构,揭示了多肽类配体和阿片受体的结合模式,阐述了它们的选择性和保守性机制,为“信使-信箱-效能”模式提供了结构和功能支持,相关成果发表在国际期刊《细胞》上。
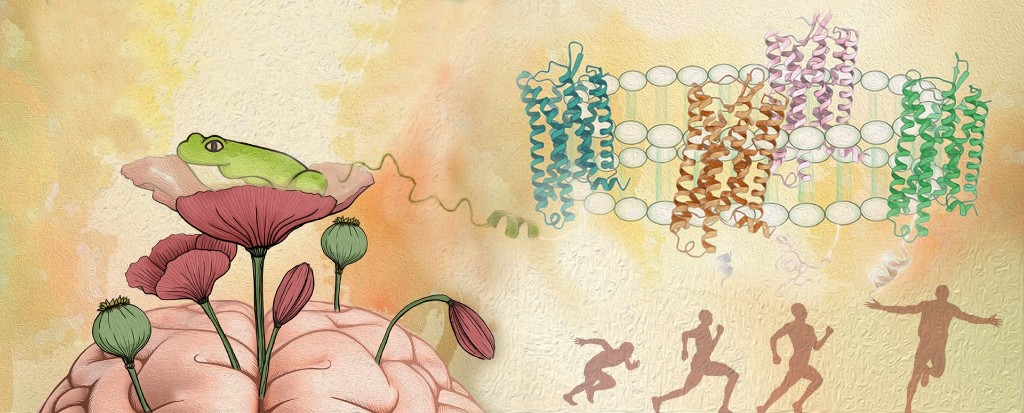
图为一个盛开着罂粟花的大脑,罂粟是阿片类镇痛药的重要来源。罂粟花上有一只青蛙,表示此研究中使用了来自青蛙皮肤表面的皮啡肽。图像右侧是四个被激活的阿片受体的结构被嵌在细胞膜内。来自罂粟中的阿片物质模拟了人体内的阿片肽功能,均通过结合阿片受体来调控人体内镇痛、感知、奖赏等生理活动。上海药物所供图
在此项研究中,研究人员首先通过细胞水平的功能实验,较为系统地分析了阿片肽对野生型阿片受体的信号传导特性。研究发现,所有的阿片肽都是以N端插入的方式进入受体,阿片肽的N端基序YGGF(痛敏肽是FGGF)“信使”结合在阿片受体极为保守的正构结合口袋腔室里,该保守腔室对配体的识别和药理活性是必不可少的,合成的YGGF四肽便可以通过较弱的作用激活四个受体。大规模功能突变实验结果表明,阿片受体ECL2/3和TM2/6/7的胞外端序列不保守性和带电差异性共同决定着阿片受体对阿片肽的选择性结合。
NOPR是阿片受体家族中最后一个被发现的受体,没有被冠以希腊字母名称,此研究解析的痛敏肽结合NOPR的结构,也是首个激活形式NOPR的结构,通过结构比对分析,不发现它遵循阿片受体通用的激活机制。
研究团队通过解析阿片肽结合的阿片受体结构,系统地阐释了多肽配体的结合模式,揭示了阿片受体中保守的结合口袋以及独特的ECL2/3共同介导阿片肽的作用机制,阐明了阿片受体通用的激活机制以及对下游Gi蛋白的选择性特征。这些工作为理解阿片系统的生物学特性提供了夯实的结构基础,为设计新型高效的阿片肽类镇痛药物铺平了道路。