近日,国家纳米科学中心研究员杨延莲、项目研究员朱凌与中国医学科学院基础医学研究所研究员余佳合作,在基于工程化细胞外囊泡药物递送体系的肿瘤N6-甲基腺嘌呤核苷酸甲基化(m6A)表观遗传调控与免疫疗法方面获新进展。相关研究成果以m6A Reader YTHDF1-targeting Engineered Small Extracellular Vesicles for Gastric Cancer Therapy Via Epigenetic and Immune Regulation为题,发表在《先进材料》(Advanced Materials)上。
m6A是存在于真核生物中最普遍的RNA转录后修饰,参与DNA修复、细胞分化及细胞周期凋亡等基本生命活动,在肿瘤起因和发展中有重要作用。RNA甲基化含量和甲基化RNA的稳定性、代谢、表达、生物功能由甲基转移酶、脱甲基酶及m6A阅读蛋白动态调节。研究表明,m6A 甲基化阅读蛋白YTH N6甲基腺苷RNA结合蛋白1(YTHDF1)在胃癌组织中过表达,且与胃癌的发生、进展及远端转移相关。因此,靶向YTHDF1并进行m6A的表观遗传调控有望实现对胃癌的抑制和治疗。靶向YTHDF1进行RNA干扰是有效的策略,然而尽管胃癌组织YTHDF1高表达,但正常组织中YTHDF1也广泛分布,所以m6A表观遗传调控存在特异性差、具系统毒性和免疫原性等问题,限制了该方法的临床应用。此外,核酸药物的递送效率也是亟需解决的问题。
针对核酸药物递送问题和胃癌组织靶向问题,科研团队构建了基于细胞外囊泡的工程化纳米药物递送体系,通过靶向和调控m6A表观遗传调控因子用于胃癌的治疗。细胞外囊泡是细胞产生的具磷脂双分子层结构的囊泡结构,具有良好的生物相容性、低免疫原性和低毒性,被认为是药物递送的理想纳米载体。工程化修饰后的细胞外囊泡可靶向递送敲降YTHDF1表达的siRNA,并以m6A依赖的方式抑制Wnt通路受体卷曲蛋白FZD7的翻译,致使Wnt/β-catenin通路失活,进而抑制胃癌细胞的增殖和发生进展。同时,科研团队发现肿瘤细胞的YTHDF1降低后,可介导干扰素(IFN)-γ受体1 (IFNGR1)的过表达,增强IFN-γ效应,促进肿瘤细胞主要组织相容性复合体I(MHC-I)的表达,使免疫原性肿瘤细胞直接实现自呈递,有效激活细胞免疫反应。通过表观遗传调控和免疫调节相互作用抑制胃癌的发展和转移,为胃癌治疗提供新策略。
研究工作得到中科院战略性先导科技专项、国家重点研发计划和国家自然科学基金的支持。
论文链接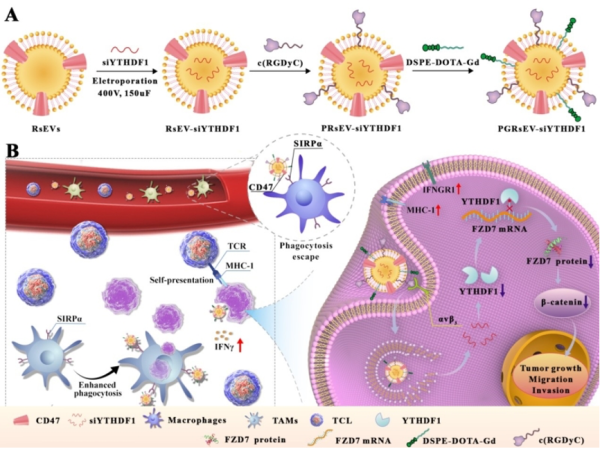
内容来源:中国科学院
来源:中国科学院
原文链接:http://www.cas.cn/syky/202212/t20221215_4858109.shtml
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn