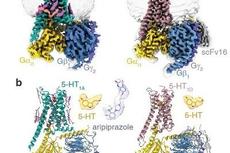
G蛋白偶联受体(GPCRs)是真核生物中最大的一类膜蛋白,在感知胞外信号和介导胞内信息转导中发挥了重要作用,并参与调控多种生理过程,与人类疾病密切相关,是重要的药物靶标蛋白家族。GPCR与第二信使环磷酸腺苷相关的信号通路中,主要通过刺激型G蛋白(Gs)和抑制型G蛋白(Gi)来区分细胞内不同的信号传递方式。了解受体对Gs和Gi信号通路的选择性机制是人们在GPCR和相关信号转导领域长期关注的科学问题。 5-羟色胺(serotonin, 5-HT)是人体中枢神经系统和周围神经系统的主要神经递质之一,其通过结合5-羟色胺受体发挥调控食欲、记忆、认知,情绪调节和成瘾等生理过程,这也使5-羟色胺受体成为抑郁症、精神分裂症、偏头痛等疾病的重要治疗靶点。5-羟色胺受体家族是GPCR超家族中最复杂的亚家族之一,其包含12种亚型,不同亚型的受体在人体中发挥不同的生理功能,并且与不同种类的G蛋白偶联。其中5-HT4、5-HT6和5-HT7受体主要偶联下游Gs蛋白,5-HT1和5-HT5受体主要偶联下游Gi蛋白。对于在同一内源性配体5-HT激活后,不同亚型的5-羟色胺受体如何偏好地偶联下游G蛋白来调控细胞应答还不清楚。 近日,中国科学院上海药物研究所研究员徐华强团队,联合浙江大学教授张岩团队以及丹麦哥本哈根大学教授David E. Gloriam团队等,在Molecular Cell上以GPCRs steer Gi and Gs selectivity via TM5-TM6 switches as revealed by structures of serotonin receptors为题发表最新研究成果,取得了5-羟色胺受体结构和功能领域又一重要进展,成功解析了5-HT4、5-HT6、5-HT7受体与激活型G蛋白(Gs蛋白)和5-HT4受体与抑制型G蛋白(Gi蛋白)结合的复合物三维结构。该研究系统性地揭示了小分子配体5-HT和5-CT识别5-羟色胺受体亚型的结构基础,并阐明了5-羟色胺受体选择性偶联Gs蛋白和Gi蛋白的分子机制。 研究团队采用单颗粒冷冻电镜技术分别对5-HT激活5-HT4、5-HT6形成的Gs复合物、5-CT激活5-HT7形成的Gs复合物和5-HT激活5-HT4形成的Gi复合物进行了结构重塑,最终解析了4个在配体激活状态下与不同蛋白的复合物结构,其中5-HT-5-HT4-Gs复合物结构的分辨率为3.1埃,5-HT-5-HT6-Gs复合物结构的分辨率为3.3埃,5-CT-5-HT7-Gs复合物结构的分辨率为3.2埃,5-HT-5-HT4-Gi复合物结构的分辨率为3.2埃(图1)。该团队将所获的这三种Gs偶联的5-羟色胺受体与Gi偶联的5-羟色胺受体进行了结构比较,并与已发表的19种Gs和Gi偶联的A类GPCRs结构进行比较。他们发现,跨膜螺旋TM5和TM6长度作为“macro-switch”来分别确定受体对Gs和Gi的选择性,且这种TM5-TM6长度的“macro-switch”由A类GPCRs-G蛋白结构共享。此外,TM5和TM6中的特定残基充当“micro-switches”与Gs或Gi形成特定的相互作用。这些结果展示了A类GPCRs的Gs和Gi蛋白偶联选择性或混杂的共同机制(图2)。 为探究G蛋白偏好5-羟色胺受体的假设,该团队进行了两组实验来检验TM5和TM6的长度是GPCR区分Gs和Gi蛋白的关键因素的假设。第一组实验是将5-HT1A受体的TM6末端螺旋断裂且TM5螺旋延伸或5-HT4、5-HT7受体的TM5末端螺旋断裂且TM6螺旋延伸,功能结果表明这种改造影响了5-HT4、5-HT7受体偶联Gs蛋白的能力,然后将5-HT1A受体由原来Gi偶联转变成了Gs偶联,这些结果支持TM5和TM6长度的“macro-switch”是G蛋白选择性的关键。第二组实验是将Gi偶联的5-HT1A的TM5-TM6区域与Gs偶联的5-HT4和5-HT7受体的TM5-TM6区域互换。研究结果表明,嵌合受体5-HT1A (5-HT4_P5.50-P6.50)与野生型5-HT4具有相似的功能,即具有高组成型激活且几乎不受配体调节。同样,5-HT1A (5-HT7_P5.50-P6.50)显示出与野生型5-HT7相似的功能,在激动剂诱导下进行的cAMP积累。如果将5-HT4和5-HT7的ICL3替换为5-HT1A,在激动剂诱导下进行的cAMP积累的能力几乎丧失,类似于野生型5-HT1A受体。综上所述,该团队以5-羟色胺家族受体为切入点揭示了A类GPCRs的Gs、Gi蛋白偶联选择性机制,并扩展了5-羟色胺受体的配体识别基础。 徐华强团队长期致力于5-羟色胺家族受体的结构与功能研究,并取得了一系列系统性研究成果。2013年,该团队于在Science上首次报导了激动剂结合的5-HT1B受体的高分辨率晶体结构;2018年,在Cell Discovery发表了首个反向激动剂结合的5-HT1B受体的晶体结构;2021年3月,在Nature上首次报道了5-HT1A、5-HT1D、5-HT1E受体的结构,并揭示了磷脂PI4P(PtdIns4P)和胆固醇调节受体功能的机制和受体的本底激活机制;2021年7月,在Cell Research上首次报道了5-HT1F受体的结构,并揭示了偏头痛药物拉米替坦对该受体的选择性结合机制;2022年5月,在Cell Discovery上首次报道了5-HT5A受体的结构。 在前期研究基础上,该研究不仅揭示了A类GPCR选择性偶联G蛋白的分子机制,首次报道5-HT4、5-HT6、5-HT7受体结构,使所有12种5-羟色胺受体亚型的结构均得到了解析。这些针对5-羟色胺受体的系统性研究丰富了人们对5-羟色胺系统的结构与功能认识,并为开发治疗抑郁症、精神分裂症、偏头痛等疾病的药物提供了重要基础。 图1 5-HT4、5-HT6和5-HT7受体结构
图1 5-HT4、5-HT6和5-HT7受体结构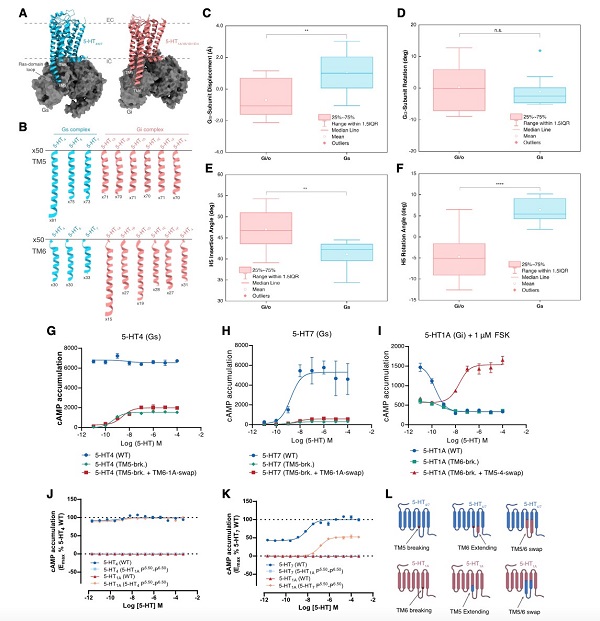 图2 5-羟色胺受体TM5、TM6对G蛋白选择性偶联的影响
图2 5-羟色胺受体TM5、TM6对G蛋白选择性偶联的影响
内容来源:中国科学院
论文链接
 图1 5-HT4、5-HT6和5-HT7受体结构
图1 5-HT4、5-HT6和5-HT7受体结构 图2 5-羟色胺受体TM5、TM6对G蛋白选择性偶联的影响
图2 5-羟色胺受体TM5、TM6对G蛋白选择性偶联的影响 内容来源:中国科学院
来源:中国科学院
原文链接:http://www.cas.cn/syky/202206/t20220617_4838610.shtml
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn