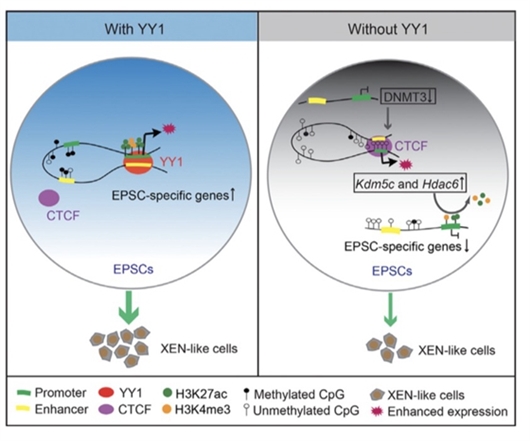
YY1调控EPS细胞扩展潜能性的新机制。姚红杰课题组 供图
YY1是EPS细胞特性的捍卫者。姚红杰课题组 供图
中国科学院广州生物医药与健康研究院研究员姚红杰课题组在干细胞扩展潜能表观遗传调控机制方面取得新进展。相关研究4月16日以“突破性研究论文”(Breakthrough Article)的形式在线发表于《核酸研究》(Nucleic acids research)。该研究得到北京大学邓宏魁教授和徐君研究员的大力帮助。
干细胞全能性对理解哺乳动物早期胚胎发育及再生医学应用至关重要。然而,传统胚胎干细胞(Embryonic stem cells,简称为ES细胞)向胚外组织发育的潜能有限,不具备全能性,在模拟早期胚胎发育及再生医学应用等方面具有局限性。
早在2017年,北京大学邓宏魁教授团队和香港大学刘澎涛教授团队报道了通过小分子化合物将传统ES细胞诱导成为兼具胚内及胚外发育潜能的类全能性干细胞,并将其命名为扩展潜能干细胞(Extended pluripotent stem cells 或Expanded potential stem cells,简称为EPS细胞)。EPS细胞为组织再生提供了重要的种子细胞,具有重要的应用价值。然而,调控EPS细胞扩展潜能性的分子机制仍不清楚。
在本项研究工作中,研究人员绘制了ES细胞和EPS细胞的染色质开放图谱,发现YY1显著富集在EPS细胞染色质特异开放区域,暗示其对EPS细胞具有潜在的调控作用。研究人员发现YY1可以通过介导(Enhancer)与启动子(Promoter)的相互作用维持EPS细胞特异基因的表达,包括Dnmt3l及Epas1等与胎盘发育相关基因。
研究人员进一步揭示敲降Yy1使DNA甲基化相关因子DNMT3A,DNMT3B及DNMT3L的表达下调,进而导致EPS细胞的全基因组甲基化水平显著降低。随后,研究人员发现DNA甲基化水平的减弱促进了DNA敏感结合蛋白CCCTC结合因子(简称CTCF)在这些区域的结合,并使CTCF在组蛋白H3K4me3去甲基化酶5C(Kdm5c)和组蛋白去乙酰酶6(Hdac6)基因上介导的EP相互作用增强,促进Kdm5c和Hdac6的表达,并导致EPS细胞特异基因启动子区域H3K4me3和H3K27ac的富集水平显著减弱。
同时,研究人员发现敲降Yy1导致EPS细胞的基因表达模式接近于ES细胞,而过表达Yy1使部分EPS细胞特异基因在ES细胞中表达。为了探究YY1是否可以调控EPS细胞的胚外发育潜能,研究人员进一步利用体外胚外细胞分化系统结合单细胞转录组测序技术,发现敲降Yy1使EPS细胞向胚外内胚层(Extra-embryonic endoderm,XEN)样细胞的衍生能力减弱,揭示YY1是EPS细胞维持胚外发育潜能所必需的因子。
该研究揭示了YY1在调节表观遗传交互调控中发挥着极其重要的作用,并阐明YY1通过调控DNA甲基化和组蛋白修饰的二维层面和染色质高级结构的三维层面,进而调控EPS细胞的特性和分化潜能。
相关论文信息:https://doi.org/10.1093/nar/gkac230
(作者:朱汉斌 来源:中国科学报)

