3月22日,中国科学院深圳先进技术研究院脑认知与脑疾病研究所、深港脑科学创新研究院研究员杨帆课题组在Molecular Psychiatry上发表题为Cav3.1-driven bursting firing in ventromedial hypothalamic neurons exerts dual control of anxiety-like behavior and energy expenditure的研究成果,揭示了慢性压力应激中下丘脑腹内侧核团(Ventromedial hypothalamus, VMH)神经元的簇状放电对焦虑及能量代谢的调控作用,而钙离子通道Cav3.1在上述调控中扮演了重要角色。该研究成果不仅深入解析了压力应激导致焦虑与代谢异常的神经机制,也为干预焦虑应激相关疾病提供新的干预策略。
压力应激导致的焦虑是一种常见的情绪状态,但长期慢性的焦虑不仅会影响心理健康,也会对机体生理功能产生严重的负面作用。许多证据表明,当长期处于过度焦虑应激状态时,机体的交感神经会过度兴奋并导致糖脂代谢异常、内分泌紊乱、骨质流失等生理稳态失衡现象,然而压力应激影响焦虑与代谢的神经机制至今尚不完全清楚。此外,近年来一系列研究还发现VMH在焦虑与代谢调节中能够发挥重要作用,但其神经元在压力应激下调节焦虑与能量代谢的神经机制也亟待深入解析。
通过研究,该研究团队发现了慢性压力应激小鼠出现焦虑样行为和代谢平衡异常(摄食减少、能量消耗降低),其VMH中簇状放电神经元的比例和强度也会显著上升。研究利用光遗传技术调控VMH神经元可以诱发簇状放电和VMH钙活动增强,而持续诱发的簇状放电则能够模拟慢性压力应激类似的焦虑样行为以及代谢变化。为进一步验证簇状放电的作用机制,研究团队利用离体电生理、在体给药、RNAi干扰等技术发现钙离子通道Cav3.1可介导VMH神经元簇状放电,而且Cav3.1表达下降会显著降低焦虑小鼠VMH中簇状放电神经元的比例,从而缓解小鼠的焦虑样行为以及代谢异常。此外,慢性压力应激小鼠长时间服用的抗焦虑药物——氟西汀,可以降低簇状放电神经元比例,阻断慢性压力应激诱发的焦虑情绪并缓解外周能量代谢异常。
该研究团队长期开展中枢神经调控骨代谢的机制研究,前期与合作者发现VMH参与慢性压力应激引发焦虑和骨丢失的神经环路 (Journal of Clinical Investigation,2020)、光调控甲状旁腺素分泌干预骨丢失(Nature Communications,2022)。
相关研究工作获得国家自然科学基金、中科院、广东省及深圳市项目的支持。
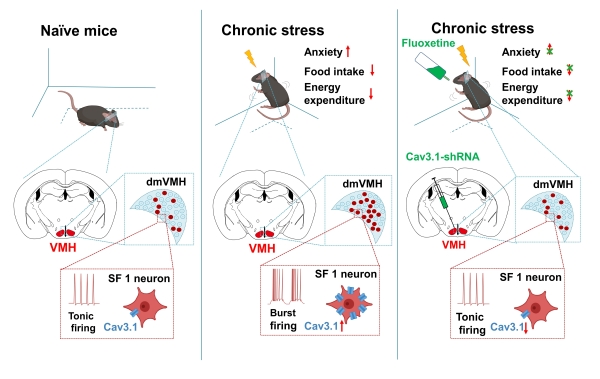
0VMH神经元簇状放电调控焦虑样行为及能量代谢
内容来源:中国科学院
来源:中国科学院
原文链接:http://www.cas.cn/syky/202203/t20220324_4829212.shtml
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn


