在包括人类在内的高等真核生物中,有一类长度约为19~30个碱基的小RNA,在调控基因表达、抗病毒以及维持基因组稳定性等一系列重要生理过程中起着关键作用。
已有研究揭示,Dicer核酸内切酶(以下简称Dicer酶)是小RNA生物合成的核心分子,小RNA均为Dicer酶切割前体RNA而成。不同小RNA长度的差异主要取决于不同Dicer酶的特异性切割。
南方科技大学教授杜嘉木联合深圳大学医学部副教授李思思及美国合作者,以植物DNA甲基化通路中的Dicer酶DCL3为研究对象,首次从整体层面解析了Dicer酶识别和切割RNA的作用机制。10月15日,相关研究结果发表于《科学》。
重要又神奇的酶
根据来源和功能不同,小RNA可以分为很多类,不同种类的小RNA拥有特定的长度。例如,植物中负责转基因沉默的小RNA是21-nt(核苷酸),而负责调控DNA甲基化的小RNA则是24-nt。
杜嘉木告诉《中国科学报》:“这些区别产生的根源在于,小RNA的生成需要一类叫作Dicer的酶去切割前体RNA,而Dicer酶同时具备‘分子尺’和‘分子刀’的功能,可以测量产物RNA的长度并定点切割前体RNA。”
值得注意的是,不同的Dicer酶可以测量并产生不同长度的小RNA。因此,可以说Dicer酶是小RNA生物合成的核心分子,它直接决定了所产生小RNA的长度、链特异性以及RNA的末端选择性等关键特征。
Dicer酶的分子作用机制一直是小RNA领域的研究热点,既往研究也获取了其在各个状态下的结构。然而,Dicer酶是一个动态性非常强的酶。杜嘉木介绍,在催化过程中,它可以和多种辅助因子结合,完成抓取前体RNA、将RNA放置到活性位点,并开展定点切割等一系列动态过程。
此外,既往研究没有观测到切割状态下的Dicer酶是如何从一侧抓取RNA的末端,并利用自身作为“分子尺”量取特定长度,随后在RNA另一侧定点切割的。
杜嘉木指出,此前Dicer酶切割机制的研究已积累了很多生化数据,为本研究做了重要铺垫。例如,发现Dicer酶家族成员DCL3作用机制需要其前体RNA的先导链5’端第一个碱基是磷酸化的A,互补链3’端需要有1-nt的末端突出,DLC3可以量取24-nt的小RNA等。
无心插柳:抓到Dicer酶活性状态
在植物中,DNA甲基化的从头建立需要一个植物特有的信号系统——RNA指导的DNA甲基化。这个系统中采用了长度为24-nt的小RNA作为信号来介导DNA甲基化。
“植物利用DCL3特异性生成24-nt的小RNA来介导DNA甲基化。”杜嘉木强调,虽然这个通路在动物体内并不存在,但是动植物在基于Dicer酶的小RNA生成方面的生化机制相同。
研究人员在研究植物DNA甲基化时,非常幸运地抓到了DCL3的活性状态。
“我们发现DCL3几乎没有结合因子,而其自身的酶活性非常高,非常适合作为模型系统来研究Dicer酶的测量和切割机制。”杜嘉木说。
为此,研究人员在反应体系中加了钙离子,利用钙离子模拟镁离子催化抑制切割的作用,使DCL3处于结合RNA的状态又因离子不同无法继续切割,从而卡在切割前的活性状态。
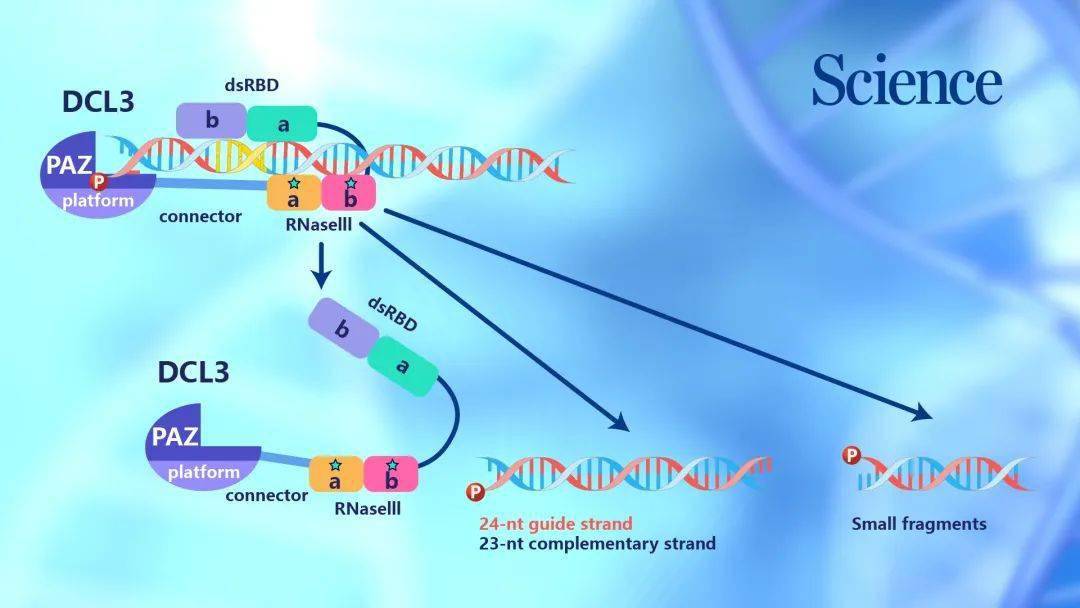
“结果正如我们所预测,实验中DCL3-RNA复合物恰好处在Dicer酶的活性切割状态,从而成功解析了DCL3识别和切割RNA的机制。”杜嘉木说,“我们观测到DCL3需要将前体RNA的第一个碱基对打开,从而使前导链和互补链的5’磷酸和3’末端突出,分别插入到Dicer酶的两个相邻的结合口袋,产生特异性识别。”
李思思补充说,基于RNA结构的生化性质测定发现,DCL3对5’起始的测量更加敏感,而对3’起始的测量具备较高的容错性。“为了证明这个推论,我们设计出不同的RNA并开展酶活实验,证实了Dicer酶更依赖于5’起始测量RNA的机制,证实了基于结构的推论。”
在切割层面,该研究还首次观测到了RNA处在Dicer酶的活性中心的构象,观测到了活性状态Dicer酶扭曲RNA,并对RNA的前导链和互补链相差2-nt同时切割的状态,解释了体内DCL3产物总是一条24-nt、另一条23-nt的原因。
“因为DCL3下游的AGO4蛋白只识别24-nt的RNA,因此该结果也解释了前期观测到的、RNA指导的DNA甲基化中小RNA的不对称性产生现象。”杜嘉木说。
人造Dicer酶或许“触手可及”
Dicer酶的作用机制是小RNA合成的核心。该研究在解析植物DCL3作用机制的过程中,也大量借鉴了动物Dicer酶研究的成果,从另一个侧面展示出Dicer酶家族在机制层面具有相当强的保守性。
李思思向《中国科学报》表示,小RNA是未来潜在的疾病治疗手段,很多基于小RNA的治疗策略正在研发当中。
“人的Dicer酶与很多疾病相关,也是目前基于RNA干扰疗法的核心。”杜嘉木表示,该研究不仅解析了植物DCL3特异性产生24-nt小RNA的机制,也在很大程度上对动物Dicer酶特别是人Dicer酶的作用机制有提示作用,这对未来RNA干扰疗法的发展及设计都有重要意义。
基于该研究揭示的Dicer-RNA互作机制,还使得人为设计Dicer-RNA成为可能。“这样,就可以在不影响体内Dicer酶正常工作的情况下,选择性切割特定RNA,这为未来Dicer酶的应用研究提供了一个新窗口和新思路。”李思思说。
杜嘉木介绍,下一步,课题组将继续设计不同的RNA,力求获取DCL3抓到RNA及将RNA放到活性位点前的状态,完整解析Dicer酶的作用机制。
相关论文信息:
https://doi.org/10.1126/science.abl4546
来源:中国科学报
原文链接:http://news.sciencenet.cn//sbhtmlnews/2021/10/365798.shtm
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn