2021年10月1日,The Plant Cell在线发表了中国科学院遗传与发育生物学研究所农业资源研究中心/河北师范大学河北省“细胞信号与环境适应”协同创新中心吕东平研究团队题为“The calcium-dependent protein kinase CPK28 is targeted by the ubiquitin ligases ATL31 and ATL6 for proteasome-mediated degradation to fine-tune immune signaling in Arabidopsis”的研究论文。
该研究报道了泛素连接酶ATL31和ATL6通过靶向钙依赖性蛋白激酶CPK28以介导其蛋白酶体降解,从而正调控拟南芥免疫反应。
植物具有和动物类似的先天免疫系统来抵御病原体入侵,并在长期协同进化过程中形成了双层防御体系。
其中,植物通过细胞膜定位的模式识别受体(PRRs)直接识别病原微生物或病原体相关分子模式(MAMPs/PAMPs)而触发的第一层免疫系统被称为模式触发的免疫(pattern-triggered immunity, PTI)。
在拟南芥中,最受关注的MAMPs之一是细菌鞭毛蛋白或其衍生肽flg22,可被质膜定位的富含亮氨酸重复受体激酶(LRR-RK)FLAGELLIN-SENSING2(FLS2)所识别。
胞质受体类细激酶BOTRYTIS-INDUCED KINASE 1(BIK1)是PTI信号通路中的关键成分,通过与FLS2等PRRs互作激活下游免疫信号。
BIK1稳态受一个调控模块维持,该模块由钙依赖性蛋白激酶CPK28和两个密切相关的泛素连接酶(PUB25和PUB26)组成。
PUB25/26可将BIK1泛素化,并介导其降解,CPK28通过磷酸化PUB25而增强其连接酶活性。
最近研究发现,免疫诱导的CPK28转录本的选择性剪接能够减弱CPK28的功能。
且最近一项蛋白质组学研究表明,CPK28在多个赖氨酸残基(Lys)上被泛素化,但目前尚不清楚CPK28泛素化的潜在机制以及CPK28是否经历蛋白酶体降解以维持免疫平衡。
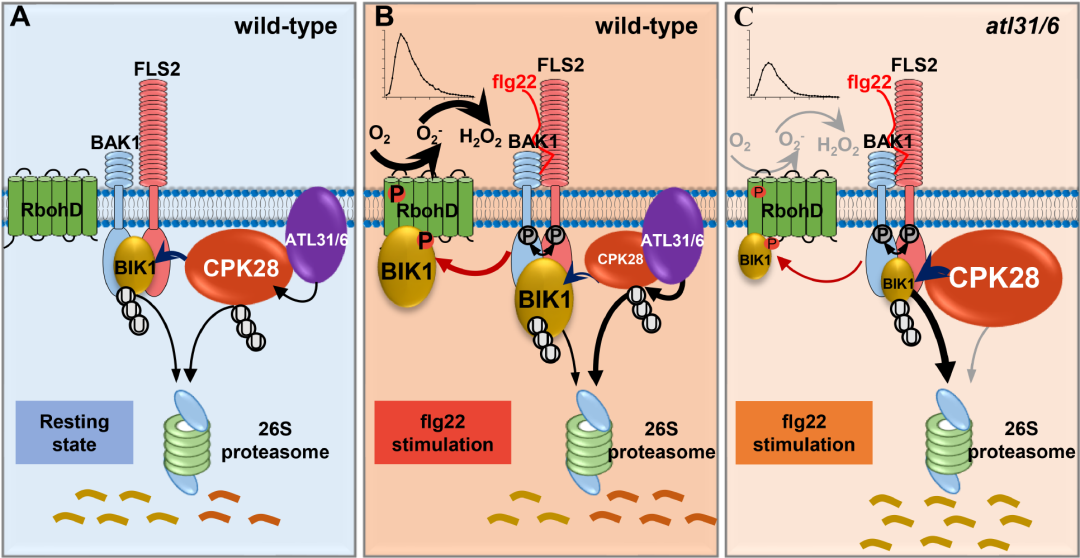
本研究发现,CPK28能够被泛素化并经历26S蛋白酶体介导的降解,且鞭毛蛋白flg22处理可促进这一过程。
筛选及鉴定结果显示,两个密切相关的泛素连接酶ARABIDOPSIS TÓXICOS EN LEVADURA31(ATL31)和ATL6与CPK28在质膜上特异性互作;这种互作因鞭毛蛋白的激发而增强。
已有研究证实ATL31/6具有泛素连接酶活性,通过进一步验证发现,ATL31/6可直接泛素化CPK28,以介导其蛋白酶体降解。
在此基础上,ATL31/6促进了 BIK1的稳定性,因而正调控BIK1介导的免疫。
该研究结果揭示了减弱免疫负调节因子CPK28功能以维持BIK1稳态和增强免疫反应的另一方式。
ATL31和ATL6靶向结合CPK28并介导其蛋白酶体降解,以增强免疫信号转导本研究特别感谢美国德州农工大学何平和单立波教授给予本研究突变体材料的帮助。
该研究得到了国家自然科学基金委、河北省自然科学基金和植物基因组学国家重点实验室的资助。
来源:植物生物学
原文链接:http://mp.weixin.qq.com/s?__biz=MzI5NTk2MTcyOA==&mid=2247499530&idx=1&sn=c10d5f791bd2774b26b7d517892480da
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

