人们对内膜系统如何重塑知之甚少。
2021年9月24日,清华大学葛亮团队在Cell Research 在线发表题为“A new type of ERGIC–ERES membrane contact mediated by TMED9 and SEC12 is required for autophagosome biogenesis”的研究论文,该研究确定了在 ER-高尔基体系统中的 ER-高尔基体中间区室 (ERGIC) 和 ER 出口位点 (ERES) 之间形成的新型膜接触,这对于促进由不同胁迫刺激诱导的自噬体生物发生至关重要。
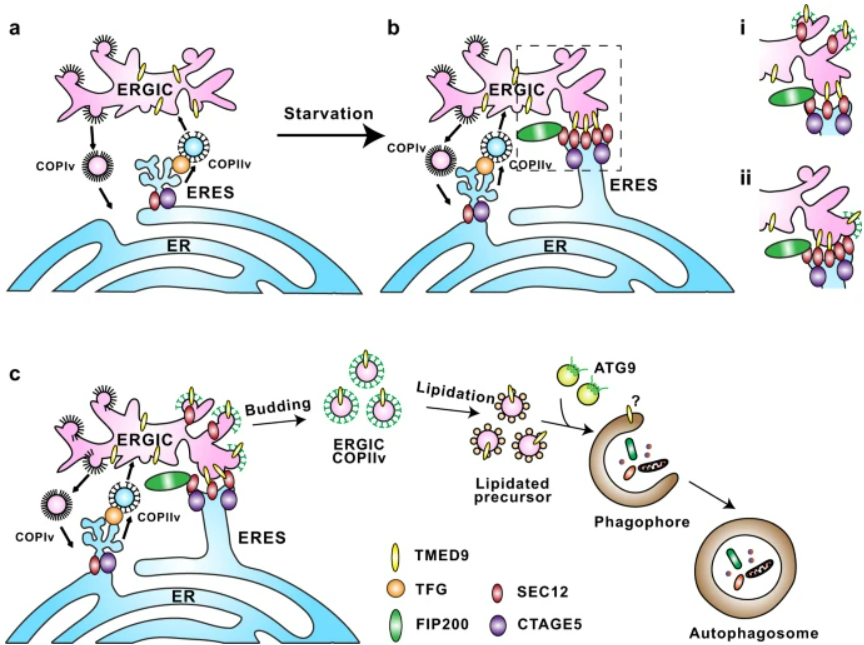
ERGIC-ERES 接触是通过 TMED9 和 SEC12 之间的相互作用建立的,这在两个隔室之间产生短距离对立(接近 2-5 nm)。
紧密的膜接触允许位于 ERES 的 SEC12 激活 ERGIC 上的 COPII 组件。
此外,SEC12 的一部分也迁移到 ERGIC。
通过这两种机制,ERGIC-ERES 接触促进了 ERGIC 衍生的 COPII 囊泡的形成,COPII 囊泡是自噬体的膜前体。
ERGIC-ERES 接触在物理和功能上不同于参与分泌蛋白转运的 TFG 介导的 ERGIC-ERES 连接,因此定义了一种独特的内膜结构,在胁迫条件下产生自噬膜形成。
另外,2020年4月8日,清华大学葛亮团队在Cell 在线发表题为“A Translocation Pathway for Vesicle-Mediated Unconventional Protein Secretion”的研究论文,该研究发现了一条调节小泡进入和无信号肽货物分泌的易位途径。
该研究将TMED10鉴定为许多无信号肽货物分泌及囊泡进入的蛋白质通道(点击阅读)。
自噬是一种由溶酶体介导的大量细胞质降解过程,涉及许多生理过程和病理条件。
自噬的调节是通过自噬相关 (ATG) 蛋白的级联信号中继实现的。
首先,由 ULK1/2、FIP200、ATG13 和 ATG101 组成的丝氨酸/苏氨酸蛋白激酶复合物在吞噬细胞组装位点 (PAS) 形成一个蛋白质支架,可能通过相变;其次,由 ATG14L、Beclin-1、VPS34 和 P150 组成的 III 类磷脂酰肌醇 (PI)-3 激酶复合物 I 被募集到内质网相关膜并催化 PI3-磷酸 (PI3P) 的形成;第三,PI3P 效应子 WIPI2 与 FIP200 一起募集 ATG16L 和蛋白质偶联物 ATG5-ATG12,后者在泛素样偶联过程中充当 E3,并与 ATG7 (E1) 和 ATG3 (E2) 一起催化LC3 蛋白与磷脂酰乙醇胺 (PE) 的共价键。
带有脂化 LC3 的膜与 ATG9 阳性囊泡结合形成杯状吞噬细胞,通过获取脂质而扩大从多个来源通过膜融合、ATG2 介导的脂质转移和脂质合成。
吞噬细胞吞噬细胞质内容物并通过 ESCRT 介导的膜断裂关闭形成双膜自噬体。
自噬体最终与溶酶体融合,或与内体和溶酶体融合,形成自噬溶酶体并完成封闭成分的降解。
降解后,通过溶酶体重组产生新的溶酶体,其特征是管状自溶酶体 。
文章模式图(图源自Cell Research )自噬的一个核心步骤是双膜自噬体的形成。
该过程需要内膜系统的膜和脂质贡献。
尽管在过去几十年中已经努力揭示自噬体的膜来源,但仍然缺乏关于哪个内膜室产生自噬膜的明确答案,特别是关于什么将隔室指定为自噬体的膜源。
最近,ER-高尔基中间隔室 (ERGIC) 作为响应不同自噬刺激的自噬体生物发生的关键膜源。
然而,ERGIC 的哪些分子成分决定了其对自噬体生物发生的贡献尚不清楚。
膜接触位点被定义为细胞内膜隔室之间形成的紧密并置区域(通常距离为 10-30 nm),其中不存在膜融合。
已经确定了多种类型的膜接触,例如,ER 已被证明与不同的细胞器(包括线粒体、质膜和过氧化物酶体)形成不同的膜接触。
这些不同类型的膜接触已被证明可以调节细胞器间的通讯和动力学,通过控制钙信号、脂质转移和膜重塑。
然而,关于膜接触的调节和功能的整体观点仍然缺乏。
最近的证据表明膜接触调节自噬体的生物发生。
ER-线粒体和 ER-质膜的膜接触位点显示为 PI3P 合成和自噬体组装的摇篮,可能充当 PAS。
在这些 ER 相关的膜接触位点上,生长的吞噬细胞之间的动态膜关联并且 ER 被指示调节自噬体的生长、成熟和运输。
尽管已经建立了自噬体膜组装的膜接触与成熟之间的联系,但尚不清楚膜接触是否以及如何调节自噬体的真正产生来自内膜系统。
在这里,该研究使用无细胞脂化、免疫隔离和质谱法,将 ERGIC 蛋白 TMED9 鉴定为非选择性和选择性自噬中多重刺激下自噬体生物发生的关键调节因子。
ERGIC 定位的 TMED9 与 ERES 蛋白 SEC12 相关联,它在 ERGIC 和 ERES 之间建立了动态和短距离(接近 2-5 nm)的膜接触。
ERGIC-ERES 接触调节 ERGIC 衍生的 COPII 囊泡 (ERGIC-COPII) 的产生,这是一种新型的 COPII 囊泡,它对自噬体生物发生具有特异性。
ERGIC-ERES 接触在物理和功能上都不同于 TFG 介导的 ERES-ERGIC 关联。
因此,该研究在 ER-高尔基体系统中发现了一种新型的膜接触,可调节自噬体膜前体的生物发生。
参考消息:https://www.nature.com/articles/s41422-021-00563-0扫码关注我们网站:www.cscb.org.cn微信:CSCB-WeChat


来源:CSCB-WeChat 细胞世界
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3ODMwOTAzNQ==&mid=2653531608&idx=3&sn=60ccc9649f7edab53c365ef3c7408b32
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn