小胶质细胞是大脑中的巨噬细胞,其在脑部疾病研究中有重要作用。在特定研究中选择合适模型及研究方法成最关键的步骤。
在"Evolving Models and Tools for Microglial Studies in the Central Nervous System"综述中,来自上海交通大学医学院的崔东红教授等探讨了体内外小鼠和人源性小胶质细胞的模型、新型单细胞技术和体内成像技术的研究进展情况。

1.小胶质细胞研究现状
小胶质细胞比其他神经胶质细胞出现早,并在神经祖细胞分化为神经元前迁至中枢神经系统,作用:
1)参与免疫调节;
2)调节神经回路建立;
3)调节多巴胺能神经元轴突生长发育及迁移;
4)调节突触密度与稳态。
小胶质细胞面临的挑战:
1)物种间异质性有不确定性;
2)小胶质细胞的发育与分化复杂;
3)作用机制复杂。
因此,合理选择研究模型和研究方法是重要的研究策略,改进模型和技术以克服当下的限制则是需要面临的挑战。
2.小胶质细胞体外研究模型
人类小胶质细胞克隆细胞3细胞系保留大部分特异性抗原,表达许多特定的标记物,是常用的模型之一。小胶质细胞系HMO6和HM1900保留有相似抗原特征和功能,能响应趋化因子和炎症刺激。
原代小胶质细胞:表达特异性表面抗原CD11b,有小胶质细胞的典型特征和功能。研究时当选用无血清培养基,避免细胞处于炎症应激状态。
诱导细胞模型:多能干细胞(iPSC)可经诱导产生小胶质细胞,将iPSC在特定氧浓度和刺激因子的条件下进行诱导,可分化成为小胶质细胞。
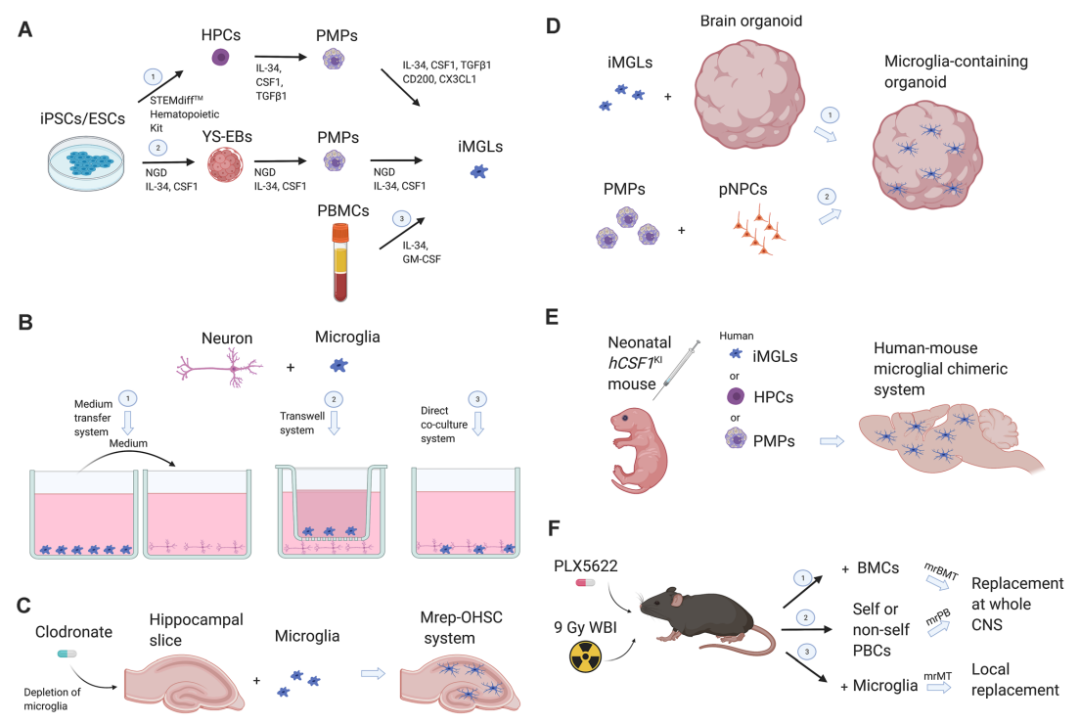
小胶质细胞的研究工具
3.小胶质细胞模型的应用
将小胶质细胞模型与其他细胞共培养,对细胞间相互作用探究:
1)细胞间的连接通讯作用;
2)细胞间分泌因子的作用;
3)细胞相关趋化因子的作用。
4.小胶质细胞的体内研究模型
小胶质细胞耗竭模型:
①CSF1R缺陷小鼠:敲除CSF1R使得小胶质细胞和其他神经元死亡。
②CD11b-HSVTK转基因小鼠:用CD11b启动子调控大脑的小胶质细胞表达单纯疱疹病毒胸苷激酶(HSVTK),用更昔洛韦诱导进行杀伤。
③人类白喉毒素受体(DTR)转基因小鼠:通过DTR处理杀伤模型中的小胶质细胞,但杀伤作用在36h内消除。另外,药物进行诱导模型可行。
▪ 小胶质细胞基因表达调控模型:小胶质细胞基因表达的改变常是通过Cre-loxP重组酶系统实现。使用CRISPR/Cas9基因组编辑技术将氨基己糖苷酶亚基β作为调控基因可稳定识别和检测体内小胶质细胞的行为。
▪ 人鼠嵌合模型:将人源性基因编辑的小胶质细胞移入小鼠中,产生新的模型。其在转录水平上模拟原代人类小胶质细胞,是检测来源与患者或特定基因修饰小胶质细胞体内功能的新型潜在技术。
▪ 替代模型:基因编辑操作存在一定局限性,但关于替代模型的研究未取得突破性进展,是因为小胶质细胞缺陷的先决条件需要创造。
5.小胶质细胞研究技术
单细胞技术:准确识别单个细胞并分析细胞群的复杂异质性,防止单个细胞的生物学信号被大量细胞的平均测量数据所掩盖。可对不同研究背景的某类细胞的转录组、表观遗传修饰以及蛋白质相互作用等探究,分析并获取特定表达谱,进而对疾病的进展了解甚至发现新的生物标志物等。
由于新鲜人脑样本获取难度高,可选替代方案:
①单核RNA测序技术:可用冻存样本分析,不适用于小胶质细胞活化基因检测。
②飞行时间质谱法:在流式细胞术的基础上联合质谱仪可对细胞表面的多种标记物分析。
体内成像技术:实时反映体内细胞的精确功能与动态。此技术为许多研究提供全新的可能性。另外,钙信号与易位蛋白等标志性分子已经在小胶质细胞的体内研究中初见成效。
总 结
通过小胶质细胞的起源分化、功能机制、开展应用于临床的靶向性药物。另外,小胶质细胞基因疗法、替代疗法、转分化疗法是未来治疗神经损伤以及神经退行性疾病的潜在方向。多组学多技术的联合应用以及多学科的研究进展将会成为小胶质细胞研究领域的关键所在。
参考文献
Zhang Y, Cui D. Evolving Models and Tools for Microglial Studies in the Central Nervous System. Neurosci Bull. 2021 Aug;37(8):1218-1233. doi: 10.1007/s12264-021-00706-8. Epub 2021 Jun 9. PMID: 34106404; PMCID: PMC8353053.
来源:brainnews
原文链接:http://mp.weixin.qq.com/s?__biz=MzI2ODEyOTE3OQ==&mid=2649605922&idx=1&sn=e5073c511113eefa1526178d95a9f18d
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn