磷酸二酯酶-4(PDE4) 是一种催化cAMP水解的酶,在记忆巩固和保留中起着至关重要的作用。
先前的研究表明,PDE4通过减少海马神经发生负向调节记忆性能,磷酸二酯酶4 (PDE4)依赖的cAMP信号在与阿尔茨海默病(AD)相关的认知障碍中起着至关重要的作用。然而,抑制前额叶皮层PDE4亚型或其剪接变体是否能正调节突触可塑性和抗氧化应激功能,并逆转β-淀粉样蛋白1-42(Aβ42)诱导的认知障碍的机制仍需阐明。
来自上海交通大学上海市第六人民医院的研究团队探究了前额叶皮层PDE4D敲低是否以及如何在行为、神经化学和分子生物学测定中逆转Aβ1-42诱导的认知障碍。

研究结果
小鼠前额叶皮质微量注射
Lenti-PDE4D-miRNA下调PDE4D表达
为了确定长型PDE4D变体在记忆中的作用,将含有4dMIR(靶向长型PDE4D(如PDE4D4/5))、正常对照序列的慢病毒载体微量注入小鼠前额叶皮质,如图1B所示。第23天,从小鼠脑中取出小鼠前额叶皮层组织进行免疫印迹分析。结果表明,前额叶皮质微量注射leni-PDE4D-miRNA可降低前额叶皮质PDE4D的表达,但不影响PDE4A和PDE4B的表达(图1C)。
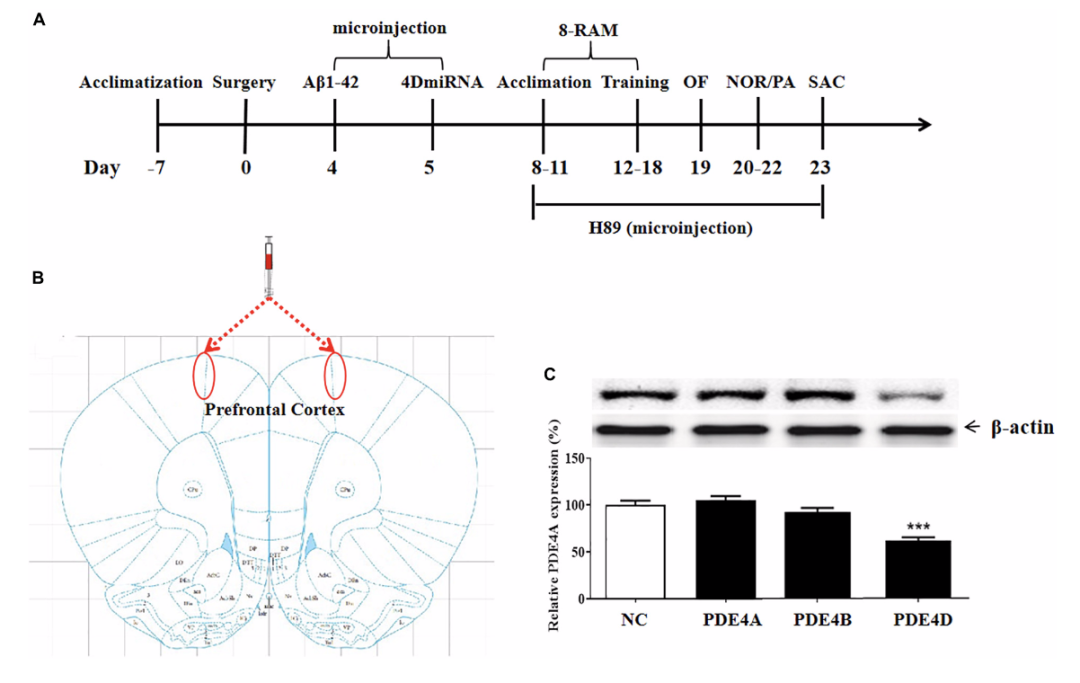
图1 实验设计和测试顺序
PDE4D基因敲除逆转新物体识别(NOR)
测试中Aβ1–42诱导的记忆损伤
为了评估PDE4D缺乏对Aβ1–42治疗小鼠认知和记忆障碍的治疗效果,进行了新物体识别(NOR)等行为测试。将小鼠暴露于一对相同的物体中5min,分别于3h和24h后观察其辨别能力。
研究发现PDE4D敲除前额叶皮质改善了Aβ1–42治疗小鼠在3小时和24小时的辨别能力。重要的是,在野外试验中,动物行走的总距离没有改变,表明敲除小鼠有类似的探索和运动功能。这些发现表明,这种效应依赖于PDE4D-PKA信号通路。
在跳台被动回避(PA)测试中,PDE4D基因敲除逆转了Aβ1–42诱导的记忆损伤,前额皮质微量注射Aβ1–42可显著增加小鼠的工作记忆错误。与载体治疗组相比,通过前额叶皮质内微量注射lenti-PDE4D-miRNA的组别小鼠工作记忆错误减少。在八臂迷宫试验中,PDE4D敲除逆转Aβ1–42诱导的记忆损伤。
PDE4D基因敲除改善了Aβ1–42
治疗小鼠前额皮质的突触可塑性
PDE4D基因敲除改善了Aβ1–42治疗小鼠前额皮质的突触可塑性,并增加了突触蛋白的表达,增加了Aβ1–42治疗小鼠前额叶皮质的SOD活性,也增加了PKA、pCREB、BDNF、Bcl2/Bax和Caspase-3的表达水平。
在Aβ1–42处理的小鼠中,下游BDNF表达降低,通过前额叶皮质微量注射lenti-PDE4D-miRNA也逆转该现象(图2C)。Bax(Bcl-2蛋白家族的促凋亡成员,Bcl-2是一种抗凋亡蛋白)和另一种与细胞死亡相关的蛋白caspase-3,在凋亡信号通路中起重要作用。如图2D所示,PDE4D缺乏逆转了Aβ1–42诱导的Bax增加和Bcl-2水平降低。如图2E所示,PDE4D缺乏逆转了这些小鼠前额叶皮质caspase-3水平升高。
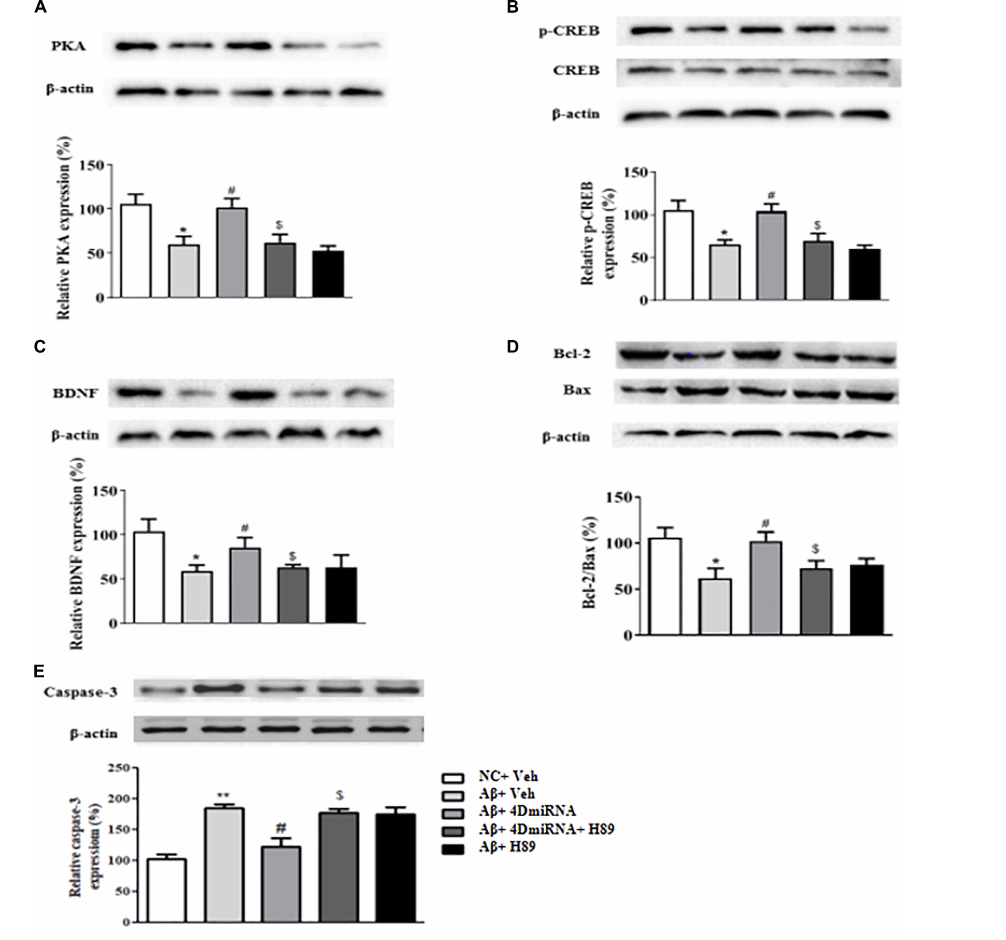
图2PDE4D缺乏增加表达的因子
讨论
众所周知,Aβ的积累会干扰cAMP激活途径,该途径在记忆检测中起着关键作用。因此,通过抑制PDE4活性,特别是PDE4亚型,开发了cAMP途径增强策略,有可能用于治疗AD或其他记忆受损相关疾病。
颞叶和额叶皮质的Aβ1–42沉积被认为是AD发病的早期和关键因素,前额叶皮层是一个PDE4D高表达的大脑区域,并且与认知有重要关系。研究结果表明,前额叶皮质内微量注射lenti-PDE4D-miRNA可降低PDE4D的表达,但不影响前额叶皮质的PDE4A和4B的水平。
总之,该研究表明,lenti-PDE4D-miRNA的记忆增强效应可能通过激活cAMP/CREB信号传导,前额叶皮质PDE4D的抑制挽救了长时程增强(LTP)和突触蛋白的表达;它还通过增加超氧化物歧化酶(SOD)和降低丙二醛(MDA)水平来增强抗氧化反应。
PDE4D敲除还增加了磷酸化cAMP反应元件结合蛋白(pCREB)、脑源性神经营养因子(BNDF)和抗凋亡蛋白Bcl-2/Bax的表达,并降低了前额叶皮质中的caspase-3水平。
这些发现扩展了先前的研究数据,并且PDE4D敲除通过其抗氧化、抗凋亡和神经保护特性改善了与AD小鼠模型中突触功能衰竭相关的记忆丧失,靶向长型PDE4D变体可能是治疗AD相关记忆丧失的潜在靶点,为AD治疗和预后提供靶点参考价值。
参考文献
YongchuanShi, Jinpeng Lv, Ling Chen, Guojun Luo, Mengjia Tao, JianchunPan,Xiaoxiong Hu, Jianwen Sheng, Shanjin Zhang, Min Zhou and HuizhenFan,PrefrontalCortex Alleviates Memory Deficits and Synaptic Failurein Mouse Modelof Alzheimer’s Disease.Front. Aging Neurosci. 13:722580.doi:10.3389/fnagi.2021.722580
编译作者: 原代美少女 (Brainnews创作团队)
校审: Simon (Brainnews编辑部)
来源:brainnews brainnews
原文链接:http://mp.weixin.qq.com/s?__biz=MzI2ODEyOTE3OQ==&mid=2649605575&idx=4&sn=baf1c1bb1f5c4611a8ece44837d78e7d
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn


