用切伦科夫光作为内光源来激发光敏剂(PS)可以克服传统光动力疗法中对于深层肿瘤的光穿透限制。然而,分开注射或共递送放射性核素和PS无法保证其在肿瘤部位的有效相互作用,也无法避免其在正常组织中的光毒性问题。因此,提高切伦科夫光介导的光动力治疗对肿瘤杀伤的选择性至关重要。
近日,中国药科大学孙晓莲教授团队和南京市第一医院邵国强副主任医师团队为解决这一问题,构建了肿瘤微环境响应型的切伦科夫自发光光敏剂材料131I-sPS NPs用于深层肿瘤的自发光光动力治疗。相关研究成果发表在Angewandte Chemie International Edition(DOI: 10.1002/anie.202107231)。
该材料以N-Alpha-芴甲氧羰基-N-Epsilon-叔丁氧羰基-L-赖氨酸作为光敏剂材料的linker骨架,修饰N, N-二异丙基乙二胺作为pH敏感基团、焦脱镁叶绿酸a (PPa)作为光敏剂、131I标记的酪氨酸作为切伦科夫光的供体以及聚乙二醇亲水长链调节材料的亲疏水平衡,最终通过自组装形成131I-sPS NPs。在中性初始条件下, 131I-sPS NPs处于聚集状态,由于聚集诱导淬灭(ACQ)作用光敏活性受到抑制。在酸性条件下,131I-sPS NPs质子化散开,ACQ作用消失,PPa在切伦科夫光照条件下持续产生活性氧 (ROS),杀死肿瘤细胞,最终能实现对肿瘤组织的选择性杀伤。
实验证明,131I-sPS NPs在避光条件下,可以在微酸环境下自发产生ROS。其对肿瘤细胞的杀伤性远大于正常细胞。在4T1荷瘤鼠模型中,相较非响应材料131I-off-PS NPs和非核素标记sPS NPs的对照,131I-sPS NPs可以有效抑制肿瘤的生长,在50天内没有任何复发。
在新西兰兔VX2原位肝癌模型中,耳缘静脉注射131I-sPS NPs,可以有效抑制深层肝癌的生长,而对正常肝组织几乎没有影响。
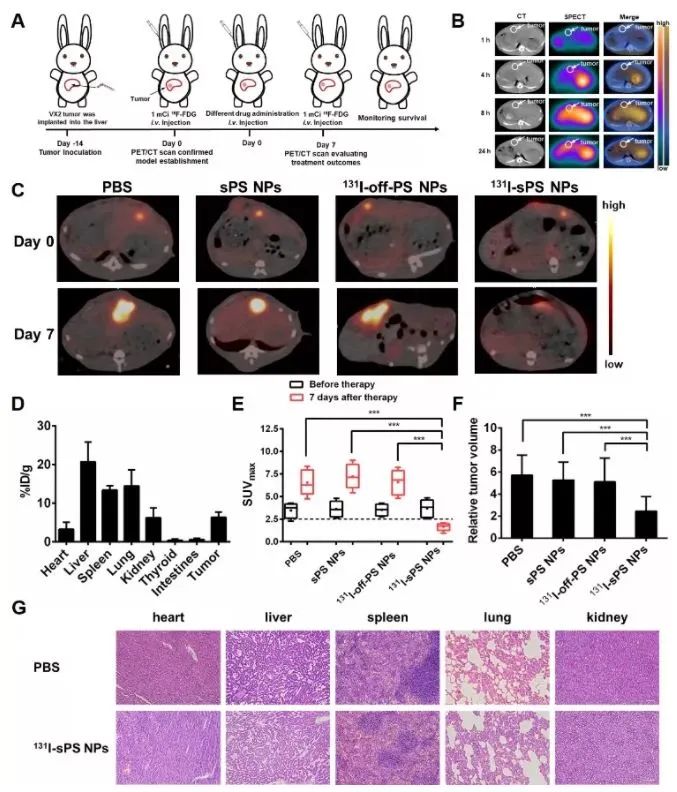
(图片来源:Angewandte Chemie International Edition)
综上所述,131I-sPS NPs能在无须外源光的条件下实现对深层肿瘤的选择性治疗,同时具有良好的生物相容性以及低毒副作用。不仅为深层肿瘤的治疗提供了有效智能的新策略,而且还有望促进切伦科夫光在生物医学领域中的进一步应用
该论文的第一作者为中国药科大学博士生郭敬儒、中国药科大学博士生冯凯、南京市第一医院核医学科药师吴文雨;通讯作者为中国药科大学孙晓莲教授和南京市第一医院邵国强副主任医师。
来源: CBG资讯
原文链接:http://mp.weixin.qq.com/s?__biz=MzI4ODQ0NjUwMg==&mid=2247535501&idx=2&sn=fb19156252e2e8b06e0969f94bd49911
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



