长期以来,星形胶质细胞及神经炎症一直与CNS系统疾病密切相关,并逐步成为相关脑病治疗的靶标,但在免疫系统和大脑之间仍有许多悬而未决的问题。
UCLA生理学与神经生物学教授Baljit S. Khakh最近提出外周神经炎症后,前额叶皮层(medial prefrontal cortex, PFC)和视觉皮层(visual cortex, VCX)星形胶质细胞和全组织基因表达变化。
星形胶质细胞反应性表型不仅是区域依赖的,而且还适于各种年龄、疾病以及疾病的阶段。本研究的发现和基因表达数据提供了丰富的信息来源,以制定和检验有关神经炎症对脑功能影响的具体假设。
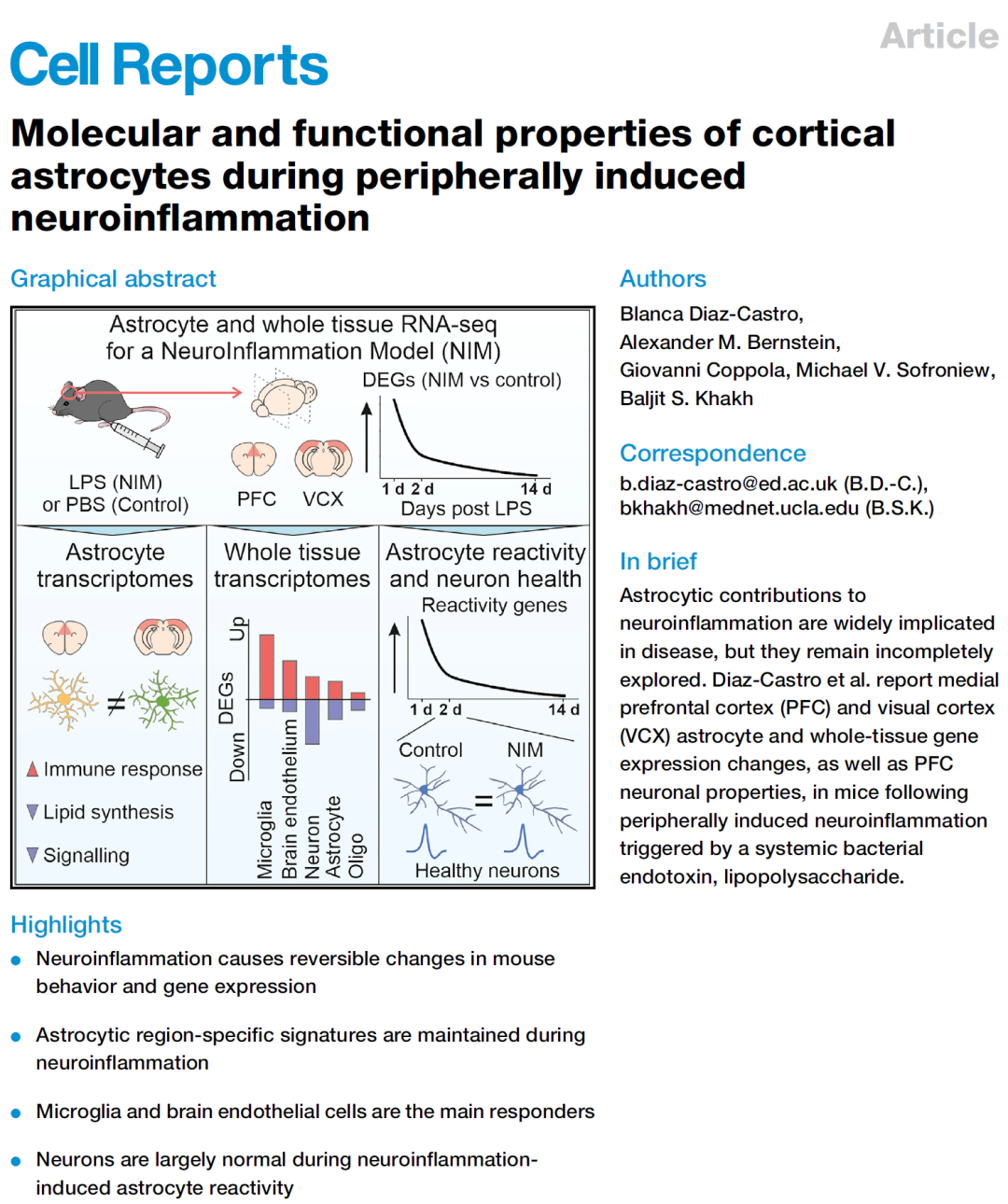
本研究通过构建了外周细菌内毒素脂多糖(lipopolysaccharide, LPS)诱导的神经炎症模型(neuroinflammation model, NIM),探索了星形胶质细胞在特定行为阶段的分子和功能概况。
LPS诱导的外周神经炎症促使小鼠的前额叶皮层(medial prefrontal cortex, PFC)和视觉皮层(visual cortex, VCX)星形胶质细胞和全组织基因表达的变化,它会诱导与抑郁症相关行为的产生,包括快感缺乏(图1)。
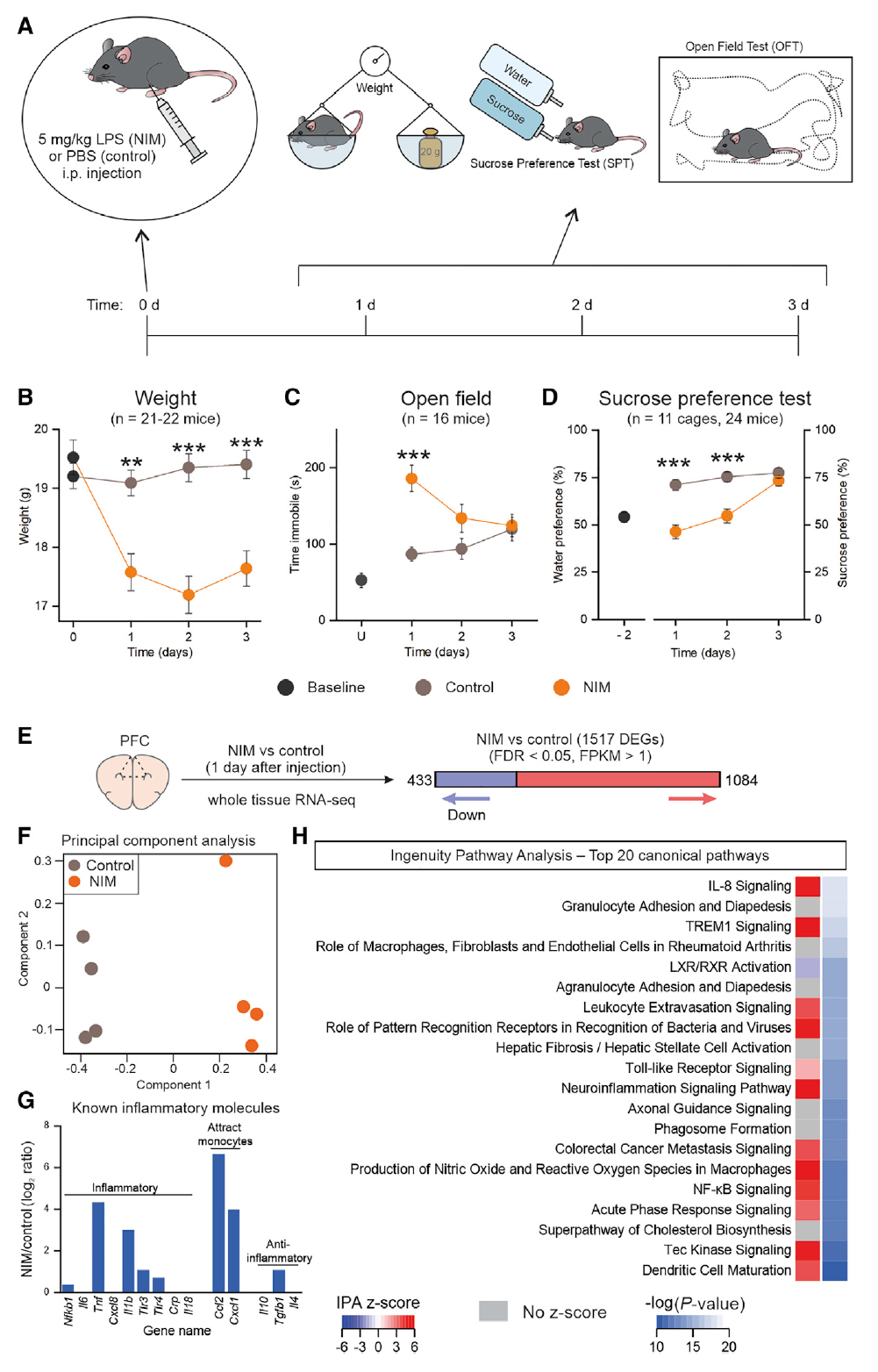
图1.LPS诱导的快感缺乏、疾病行为和整体炎症反应
为了更好地了解神经炎症在疾病(第1天)、快感缺乏(第2天)和恢复(第14天)阶段如何影响星形胶质细胞,研究对两个皮层区域进行了星形胶质细胞RNA测序,分析表明PFC与许多中枢神经系统疾病的快感缺失和认知能力下降有关,VCX参与不同的视觉回路和行为。
与NIM表型的严重程度平行,PFC和VCX中差异表达基因(differentially expressed genes, DEGs)的数量在第1天最高,其次是第2天,而第14天未发现DEGs,表明了与急性神经炎症相关的星形细胞转录变化可能是完全可逆的现象(图2)。
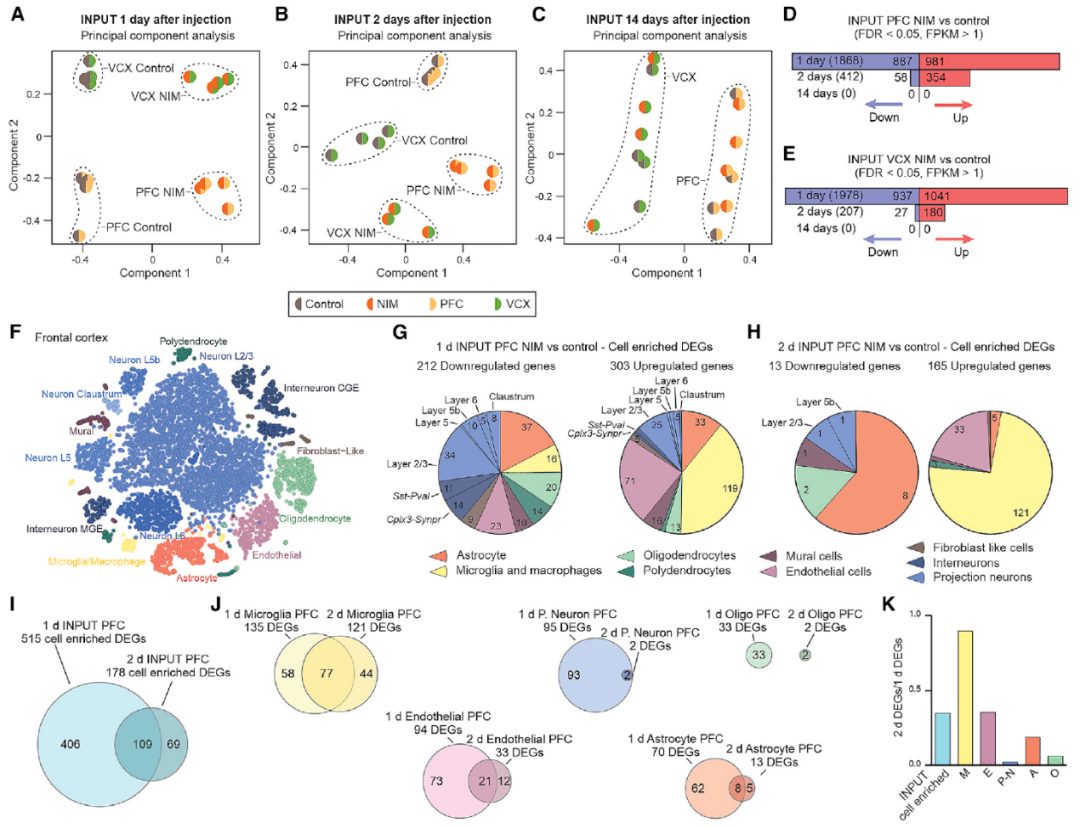
图2. 从INPUT RNA测序评估神经炎症期间PFC细胞特异性反应
研究评估了神经炎症介导的行为改变和星形细胞特异性基因表达改变在快感缺乏最严重时达到峰值,然后逆转到正常。值得注意的是,PFC和VCX星形胶质细胞的转录组在神经炎症过程中都发生了变化,但其区域特异性的分子特性在反应性变化中基本保持。
有趣的是,不同区域的星形胶质细胞对同一刺激的反应不同,可能与CNS区域对特定疾病的区域易感性有关,值得进一步的机制研究(图2)。
研究通过基因通路分析表明NIM PFC星形胶质细胞多种细胞信号通路的发生显著改变,包括细胞-细胞相互作用的改变,这可能是神经炎症的中枢效应的基础。
此外,小胶质细胞和内皮细胞也表现出明显的免疫信号激活,是NIM的主要应答者。通过细胞-细胞相互作用分析发现了几个配体-受体对,可能从内皮细胞信号到小胶质细胞和星形胶质细胞。
由于内皮细胞是血管神经单元中血液和大脑之间的第一道屏障,研究数据表明,这些细胞可能通过直接向星形胶质细胞和小胶质细胞信号转导外周炎症信号到大脑。
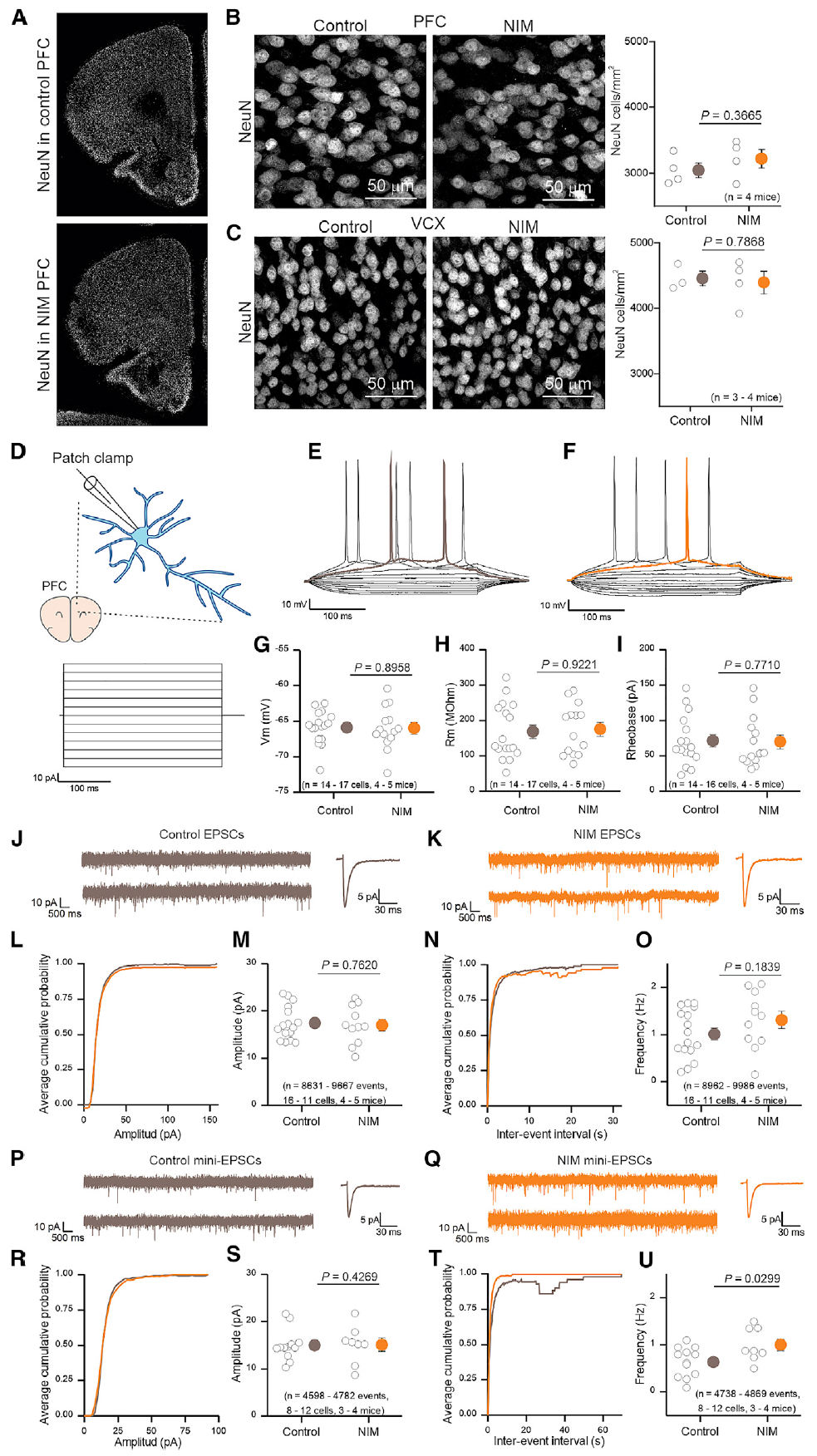
图3. 神经炎症过程中PFC锥体神经元的神经元和突触特性
研究还比较了急性外周神经炎症后PFC星形胶质细胞转录变化与慢性人类AD和小鼠AD模型中PFC星形胶质细胞的变化。虽然数据集之间的重叠并不多,但NIM、AD和其他疾病数据集之间存在一些共同的变化,如胆固醇代谢、细胞骨架动力学、缝隙连接、K+和Ca2+运输、突触可塑性以及向其他细胞的信号传导。
星形胶质细胞转录组炎症谱的增加和神经元支持功能的减少被发现是常见的表型。这些发现有助于理解与神经炎症相关的星形胶质细胞变化如何影响周围细胞,进而影响疾病过程。
此外,在NIM中,尽管星形胶质细胞上调了一组与星形胶质细胞反应性相关的基因,但这些变化并未对神经元健康或存活产生可检测到的有害影响,表明星形胶质细胞反应性可能与基本神经稳态功能的维持有关。
总 结
这些发现进一步证明星形胶质细胞在CNS先天免疫反应中发挥核心作用,有助于理解与神经炎症相关的星形胶质细胞变化如何影响周围细胞,进而影响疾病过程。
神经炎症对AD等疾病病理生理学的确切贡献还需要进一步研究,虽然可能会发生神经炎症,但这是否与疾病的表型具有因果关系仍有待完全阐明。
来源:brainnews brainnews
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



