]2021年8月19日,The Plant Journal在线发表了加拿大多伦多大学细胞与系统生物学系Wolfgang Moeder和Keiko Yoshioka为共同通讯作者的题为“Multiple phosphorylation events of the mitochondrial membrane protein, TTM1, regulate cell death during senescence”的研究论文。该研究发现在衰老相关的细胞死亡过程中,多个MPKs参与调控线粒体蛋白TTM1的功能和周转,揭示了TTM1蛋白和ABA信号通路之间的分子联系,并为线粒体和程序性细胞死亡之间的关联性提供了新证据。

衰老是一种高度调控的发育性程序性细胞死亡(PCD),对于结束植物生命周期和在不利条件下生存至关重要。除发育因素外,持续黑暗和外源ABA处理等也可触发衰老发生。线粒体作为信号枢纽在衰老过程中发挥重要作用,并在叶绿体被分解的同时为细胞提供能量。然而,目前尚不清楚线粒体参与植物PCD的确切分子机制。该团队前期研究表明,拟南芥三磷酸隧道金属酶(TTM)蛋白TTM1和TTM2是定位于线粒体外膜的尾锚定蛋白,均含有核苷酸激酶(P-loop激酶)/尿苷激酶样结构域(UK)和TTM结构域,它们分别调控衰老和免疫相关性细胞死亡。
之前研究结果显示,ttm1突变体植株在自然和暗诱导条件下表现出衰老延迟现象,说明TTM1正调控衰老。本研究通过对离体叶进行外源激素处理和叶绿素水平检测发现,ABA处理后ttm1叶片的叶绿素降解较对照明显延迟,表明TTM1参与ABA介导的衰老信号通路。
蛋白质组学研究报道,ABA处理后TTM1在S437位点的磷酸化水平增加。与此类似,暗处理同样可使S437位点磷酸化水平增加。在ttm1突变体中分别过表达TTM1和模拟磷酸化形式(S437D)的TTM1均可恢复突变体的衰老延迟表型。相反,过表达磷酸化位点缺失(S437A)的TTM1则不能回补ttm1表型,表明S437位点的磷酸化对于TTM1功能至关重要(图1)。
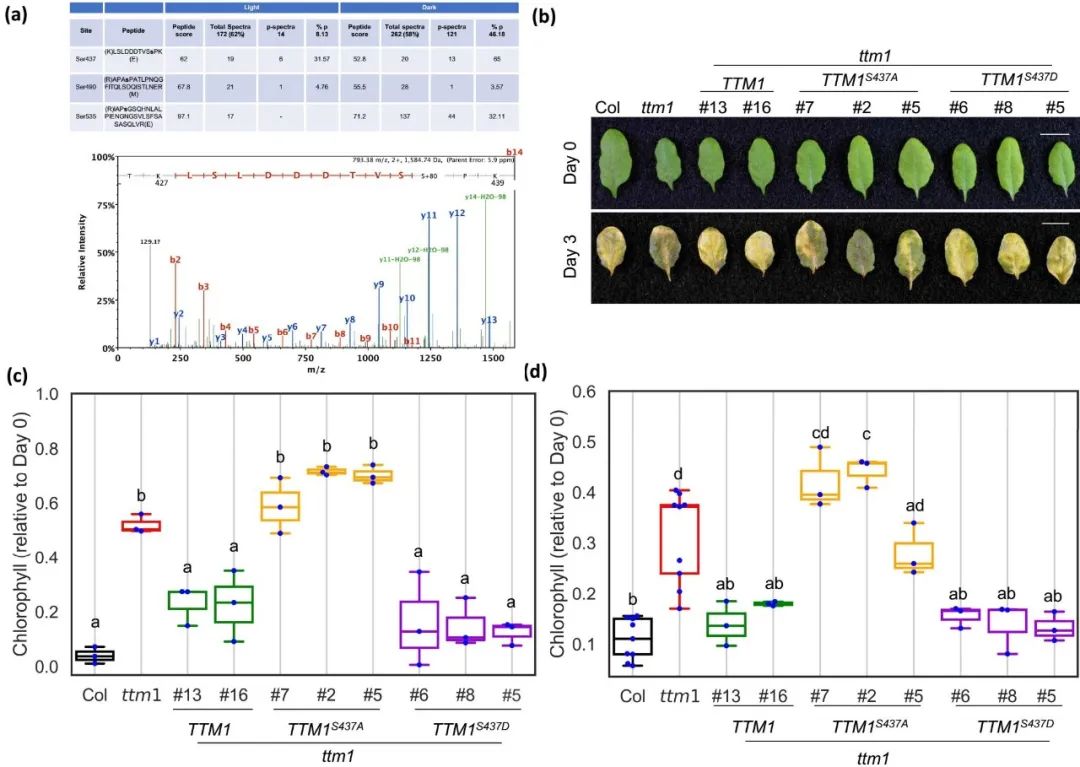
图1. S437位点磷酸化对于TTM1功能必不可少
根据已有研究成果推测MAP激酶可能作用于ABA或暗处理诱导的S437磷酸化。通过体外激酶实验发现,C组MPK1和 MPK7以及A组MPK6负责磷酸化位于UK结构域之前N末端的S10以及卷曲螺旋结构域前端的S490位点。而MPK3和MPK4可同时磷酸化包括S437在内三个位点。与S437不同的是,S10和S490位点磷酸化负调控TTM1诱导的细胞死亡。荧光观察结合蛋白量化结果表明,这两个位点的磷酸化负责调控26S蛋白酶体对TTM1蛋白的降解。
总之,黑暗(以及其他潜在衰老因素)和ABA触发MAP激酶级联,激活的MPK3和 MPK4磷酸化S437位点,由此可能引起TTM1构象变化并使其处于活化状态。该构象的改变同时也可能促使其他MAP激酶(MPK6、MPK1和MPK7)磷酸化S10和S490。一旦这些位点被磷酸化,TTM1就会作为标记蛋白被26S蛋白酶体识别以进行蛋白周转。
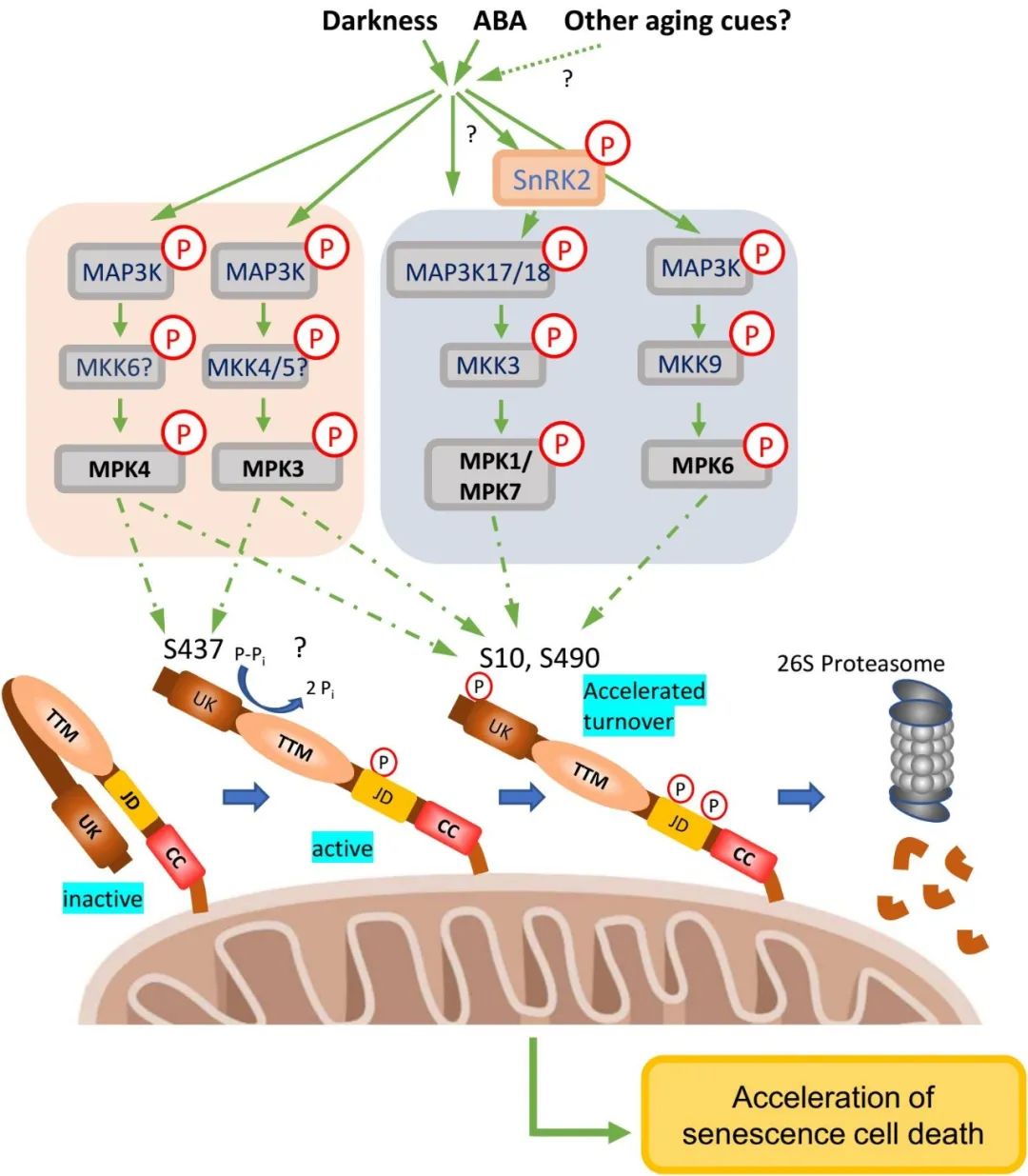
图2. TTM1功能和蛋白周转的调控模型
来源: 植物生物学
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn