来源:逻辑神经科学
撰文︱王思珍

了解突触的结构和功能、以及两者之间的关系是神经科学的一个关键问题。虽然已取得重要研究进展,然而有关突触传递的几个基本问题仍然未被完全回答:突触囊泡(synaptic vesicles)是通过完全融合来进行胞吐,还是通过瞬态融合孔来释放传递素,一直存在争议【1】。已定义的突触囊泡池的功能和结构之间的关系仍不清楚【2】。而且中枢突触的内吞作用机制也不明确【3】。
虽然,传统上认为囊泡是通过依赖于网格蛋白的内吞作用从质膜中获得的,然而,最近的研究发现了快速、独立于网格蛋白的机制【4-5】。由于中枢突触是高度多样化的,因此解决这些和其他问题需要对精确定义的突触进行结构和功能分析。
电子显微镜(electron microscopy,EM)是突触结构分析的强有力候选者,具有纳米级别的空间分辨率,然而,EM的一个很大的缺点是它只能捕获静态的图片。而且化学固定可能会改变突触的结构,因此EM捕获到的静态图片信息有偏差【6】。
共焦、双光子和光学超分辨成像不仅可以用于固定样本的突触传递,而且可喜的是,还可以用于实时活体样本的突触传递的成像。
然而,这些复杂的成像技术通常只能应用于离体培养的神经元,很难达到足够的分辨率来识别单个的激活区或单个突触囊泡。
因此,要解决中枢突触的结构-功能关系,需要适合的捕捉纳米级空间和毫秒时间分辨率突触的技术。
早期,Heuser, J.E等人尝试结合电刺激和快速组织冻结,来研究突触结构和功能的分析,研究人员在结构上证实了量子假说和突触囊泡循环的特征【7】。该技术已被成功应用于了神经肌肉接点的研究中,然而,却难以实施于中枢突触。
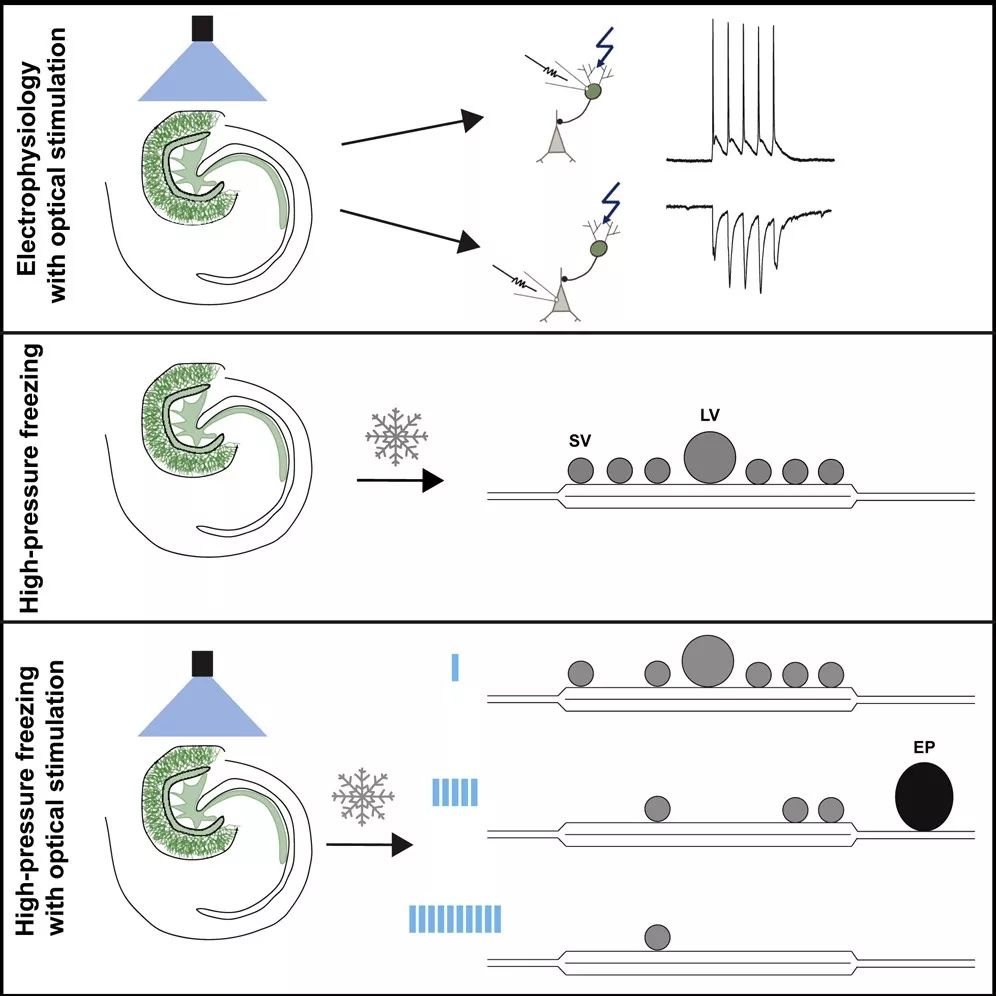
最近,这些问题有了一些解决。Shigeki Watanabe等人通过结合使用高压冷冻(high-pressure freezing,HPF)技术,即一种被称为“闪光与冻结”(flash and freeze)的技术,对识别出的突触前神经元进行光发生刺激【8】。“闪冻”技术已成功地应用于秀丽隐杆线虫神经系统和分离培养神经元【8】。
然而,对于完整的脑组织(如急性切片),特异性突触刺激和超微结构捕获,“闪冻”技术具有局限性。HPF技术不能应用于急性切片的常规制备,因为,组织的厚度和密度会导致长时间的冻结和冰晶的形成【9】。
因此,总结来说,我们对突触功能的认识主要是基于对急性切片的电生理分析,现有的技术很难对突触结构和功能数据之间建立逻辑关系,进而限制了对突触传递的整体理解。
在此,基于以上背景,奥地利科学技术研究所的Carolina Borges-Merjane(第一作者&第一通讯作者)、Olena Kim(共同第一作者)与Peter Jonas(第二通讯作者)对“闪光和冻结”技术进行了全面升级,在精确时间点上探测皮层突触传递过程中的结构变化。
该项研究工作于2020年1月9日以Functional Electron Microscopy (‘‘Flash and Freeze’’) of Identified Cortical Synapses in Acute Brain Slices为题在线发表在国际权威期刊Neuron上。

首先,与以前报道的方法不同的是,改进后的“闪光和冻结”技术适用于急性切片和器官型切片的完整网络。这些优势源于使用了薄的急性切片、改进后的载体几何结构、以及改进后的恢复方案和优化后的低温保护和冷冻技术。
基于这一依据,为了进一步验证这一技术的可靠性,研究人员探索了海马齿状回颗粒细胞(gyrus granule cells,GCs)与CA3锥体神经元之间的海马苔藓纤维突触(hippocampal mossy fiber synapse)的结构和功能,即囊泡池的变化。海马苔藓纤维突触具有大突触前末端,大量突触囊泡,以及囊泡直径的可变性等独特的结构特性。结果显示了“未释放”囊泡池(the docked vesicle pool)和在和“已释放”囊泡池(the functionally defined readily releasable pool)之间有重叠,即两种囊泡具有共同的结构和功能部分,这为随后突触的快速内吞作用提供了证据。
此外,作者展示了中度刺激后内吞的孔状结构的外观,提供了快速网格蛋白独立的内吞机制的结构证据。
最后,研究者证明这项技术具有广泛的适用性,可以用于小鼠海马组织的急性切片和器官型切片培养,也可以用于包括小脑和脑干在内的多种大脑区域的急性切片
总的来说,这一整体升级后的EM(“闪光和冻结”)技术可用于急性大脑切片突触传递过程中的多个时间点的囊泡池变化(结构和功能)机制研究。
原文链接
https://doi.org/10.1016/j.neuron.2019.12.022
参考文献
【1】Aravanis, A.M., Pyle, J.L., and Tsien, R.W. (2003). Single synaptic vesicles fusing transiently and successively without loss of identity. Nature 423, 643–647.
【2】Schikorski, T., and Stevens, C.F. (2001). Morphological correlates of functionally defined synaptic vesicle populations. Nat. Neurosci. 4, 391–395.
【3】Watanabe, S., Rost, B.R., Camacho-Pe´ rez, M., Davis, M.W., So¨ hl-Kielczynski, B., Rosenmund, C., and Jorgensen, E.M. (2013b). Ultrafast endocytosis at mouse hippocampal synapses. Nature 504, 242–247.
【4】Delvendahl, I., Vyleta, N.P., von Gersdorff, H., and Hallermann, S. (2016). Fast, temperature-sensitive and clathrin-independent endocytosis at central synapses. Neuron 90, 492–498.
【5】Korogod, N., Petersen, C.C., and Knott, G.W. (2015). Ultrastructural analysis of adult mouse neocortex comparing aldehyde perfusion with cryo fixation. eLife4, e05793.
【6】Heuser, J.E., Reese, T.S., Dennis, M.J., Jan, Y., Jan, L., and Evans, L. (1979). Synaptic vesicle exocytosis captured by quick freezing and correlated with quantal transmitter release. J. Cell Biol. 81, 275–300.
【7】Watanabe, S., Liu, Q., Davis, M.W., Hollopeter, G., Thomas, N., Jorgensen, N.B., and Jorgensen, E.M. (2013a). Ultrafast endocytosis at Caenorhabditis elegans neuromuscular junctions. eLife 2, e00723.
【8】Studer, D., Zhao, S., Chai, X., Jonas, P., Graber, W., Nestel, S., and Frotscher, M. (2014). Capture of activity-induced ultrastructural changes at synapses by high-pressure freezing of brain tissue. Nat. Protoc. 9, 1480–1495
来源:LT-Neuroscience 逻辑神经科学
原文链接:http://mp.weixin.qq.com/s?__biz=MzI4Mjk3NzUxOQ==&mid=2247485859&idx=1&sn=784d166fe0f41566133249928773d99c&chksm=eb90fc23dce7753501ff560c44d5ef8a2e1261917909433ce51e5190d8d3dbda961adc41c5a5&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

