来源:BioArt
撰文 | 章台柳
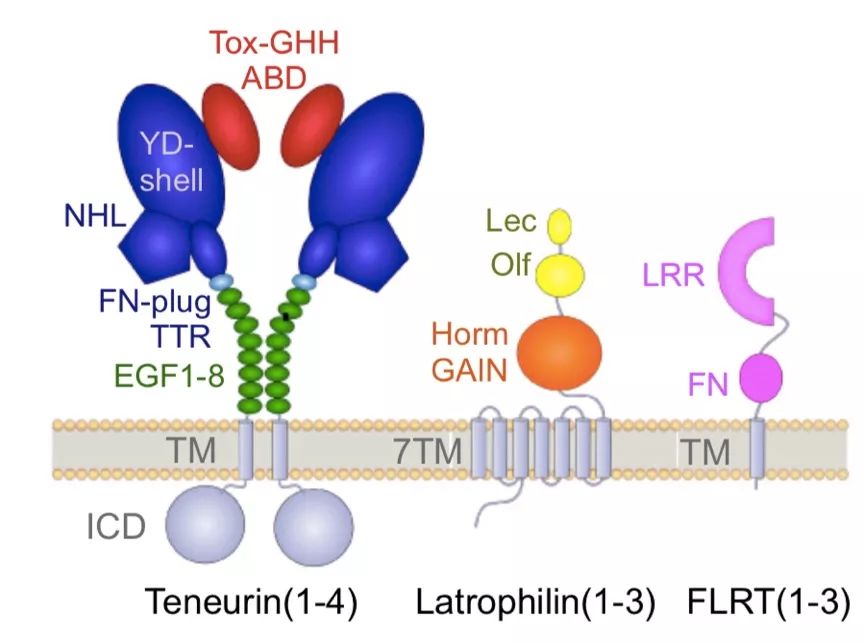
Teneurins是真核细胞的粘附受体,通过水平基因转移(horizontal gene transfer, HGT)进化而来,由细菌的毒素基因与真核受体融合形成较大的II型跨膜蛋白,在蠕虫、昆虫、脊椎动物和单细胞鞭毛虫中表达。Teneurin具有4个同源蛋白,Ten1-Ten4,主要存在于神经系统,而且从神经系统的早期发育到成年都表现出互补的表达模式【1】。哺乳动物的Teneurins是有~2800氨基酸残基的II型跨膜蛋白,其中~250KD的胞外结构域包括了至少16个带注释的结构域。近期对Gallus gallus(鸡的一种)的Ten2、小鼠的Ten3、人Ten2的结构解析揭示出由8个结构域组成保守的超级折叠结构,其具有3个特征基序:1)螺旋状β桶形酪氨酸-天冬氨酸重复序列的“YD壳”结构域;2)N末端用来封闭YD壳的特殊“纤维连接蛋白塞”结构域;3)称为NCL-1、HT2A和NHL结构域的β螺旋桨。YD壳的C末端是~200个氨基酸的连接序列,位于YD重复壳中,并穿过壳壁形成抗生素结合样(antibiotic-binding-like,ABD)和Tox-GHH结构域。Teneurins的核心折叠区域的上游有胞外转甲状腺素样结构域(TTR)和8个表皮生长因子结构域(EGF),其中2个EGF间形成二硫键介导Teneurin二聚体的形成。约180氨基酸长度的连接序列将EGF结构域和跨膜(TM)螺旋、胞内结构域(ICD)相连接。
小鼠中,Ten3和Ten2在视觉系统、海马和丘脑纹状体投射中指导轴突连接过程。Teneurins通过与Latrophilins相互作用促进突触发育和跨突触粘附。Teneurins的胞外结构域从细胞表面水解,与Latrophilins结合,在轴突导向中起引诱作用。Latrophilins(哺乳动物有Lphn1-Lphn3)是一种粘附性G蛋白偶联受体(GPCRs),近期报道其可作为机械敏感受体,参与注意缺陷多动障碍(ADHD)等神经发育障碍。突触形成过程中,Latrophilins与FLRTs相互作用,并与Unc5受体形成大型复合物。Latrophilins含有一个短的C端ICD、一个7次跨膜的GPCR结构域、GAIN/Horm、一个糖基化连接区(~100个残基)、N端Olf和Lec结构域。FLRTs具有胞外富含亮氨酸重复序列(LRR)结构域的单次跨膜I型蛋白,通过糖基化连接区与下游的FN样结构域相连。FLRT的LRR结构域和Latrophilin的Olf结构域【2】,而Teneurins需要Latrophilin的Lec结构域进行结合【3】。Latrophilin的Lec和Olf之间的连接序列会经过可变剪切,决定其与Teneurin结合的亲和力。近期研究表明,FLRT3、Lphn2/3和Ten2作为协同性受体共同作用于海马布线过程。然而,Teneurins和Latrophilins在分子水平上如何相互作用,以及Teneurins-Latrophilins相互作用是否在海马布线前的早期神经发育中起作用,目前尚不清楚。
2020年1月9日,德国Max Planck Institute of Neurobiology的Rudiger Klein和英国牛津大学的Elena Seiradake合作在Cell杂志上发表文章 Structural Basis of Teneurin-Latrophilin Interaction in Repulsive Guidance of Migrating Neurons,解析了Teneurin-Latrophilin复合物的晶体结构,揭示出Latrophilin的Lec和Olf结构域与Teneurin的螺旋β桶形YD壳结构域相互结合的结构基础。同时,使用多种技术手段证明皮层神经元迁移过程中Teneurins-Latrophilins-FLRT相互作用的重要性,且Latrophilins与Teneurins、FLRT的结合是通过一种接触排斥依赖的机制指导神经元的迁移,这种效应在细胞体/小突起中可观察到,在轴突上没有。

研究人员首先解析出分辨率为3.6Å的鼠源Lphn2 Lec结构域(残基30-137)与鸡源Teneurin2(残基1043-2802)相互作用的复合物,分辨率为3.86Å的鼠源Lphn1 Lec-olf结构域(残基29-395)与鸡源Ten2(残基955-2802)相互作用的复合物。两个结构显示Teneeurin的YD壳结构上具有Lphn Lec结构的结合位点,横跨螺旋形YD壳层的各个层,C末端的Tox-GHH/TCAP结构域距离Latrophilin结合位点约6nm,而FLRT通过表面的LRR结构域与Latrophilin Olf结构域结合,两者相互结合构成三元复合物。分子动力学模拟分析显示Lec和YD壳间相互作用较为稳固,而NHL、FN塞结构域、ABD和Tox-GHH结构域都具有可变灵活性。同时,Lec和YD壳之间的结合界面上有2个结合热点:其中一个以D55为中心,位于Lphn2-Lec的β2和β3片层之间的环,D55和Ten2 YD壳顶层的R2197形成稳定的盐桥;另一个由Lec的β1- β2和β4-h1环路组成,与Ten2 YD壳的下部结合,Lphn2的D68和D73(带负电)与Ten2的R1893和K1866(正电荷)相互结合。为了验证分子动力学模拟分析的结果,研究人员进行突变研究。结果显示,Ten2LT(不能结合Latrophilin的Teneurin)、Lphn1TL(不能结合Teneurin的Latrophilin)、Lphn1TL2突变体均导致两者间相互作用丢失,且Ten2LT、Lphn1TL不能促进K562细胞的粘附。Latrophilin和Teneurin的混合增加Latrophilin与FLRT蛋白的结合,Ten2可与Lphn1-3结合,但不能与FLRT结合,故Teneurin通过Latrophilin与FLRT结合。
之前的研究显示Latrophilin和FLRT影响胚胎皮层神经元的迁移。发育过程中,Teneurins在大脑广泛表达,在皮层中参与导向过程(pathfinding)。那么,Teneurin-Latrophilin之间的结合是否调控胚胎皮层神经元的迁移?原位杂交显示,胚胎发育13.5天到17.5天时,Lphn1和Lphn2在神经元富集层、顶端祖细胞(AP)富集层中表达,与单细胞测序数据一致,此外径向胶质细胞体(RG)也定位在这里。Teneurins主要在神经元富集层表达,在AP富集层表达减少。在皮层发育中,FLRTs在神经元中富集。进一步研究发现,Ten2和FLRT3在迁移性神经元中共表达,且两种受体都位于皮层神经元的胞体和突起/生长锥上。破坏Ten2和FLRT3间相互作用,减少两者与神经元的结合。即迁移性神经元共同表达Lphns和Teneurins,FLRTs与RG细胞或/和其他皮层神经元上Lphn相互作用。神经元迁移实验中,Lphn1(Lec-Olf)的添加导致皮层神经元的迁移速度比对照慢且距离短,但对轴突的生长没有影响。
那么Latrophilin-Teneurins-FLRTs之间的相互作用如何降低神经元迁移的速度?细胞的迁移速度主要取决于粘附和排斥之间的平衡,Lphn1(Lec-Olf)对皮层神经元有轻微的排斥作用,而且Lphn1通过与Teneurins和FLRTs的反式作用产生排斥,主要作用于迁移性皮层神经元的胞体和小突起,对皮层轴突不排斥。在皮层迁移神经元中过表达Ten2显著延缓其迁移,而过表达Ten2LT破坏相互作用则不能延缓迁移。脑切片成像显示,Ten2表达的神经元在IZ区迁移速度更慢,停留更久。然而,敲低皮层神经元的内源性Ten2导致神经源的迁移减少,竞争性抑制Lphn1导致神经元迁移严重推迟。表明Latrophilin-Teneurins-FLRTs之间的相互作用对于皮层神经元的迁移是必需的。
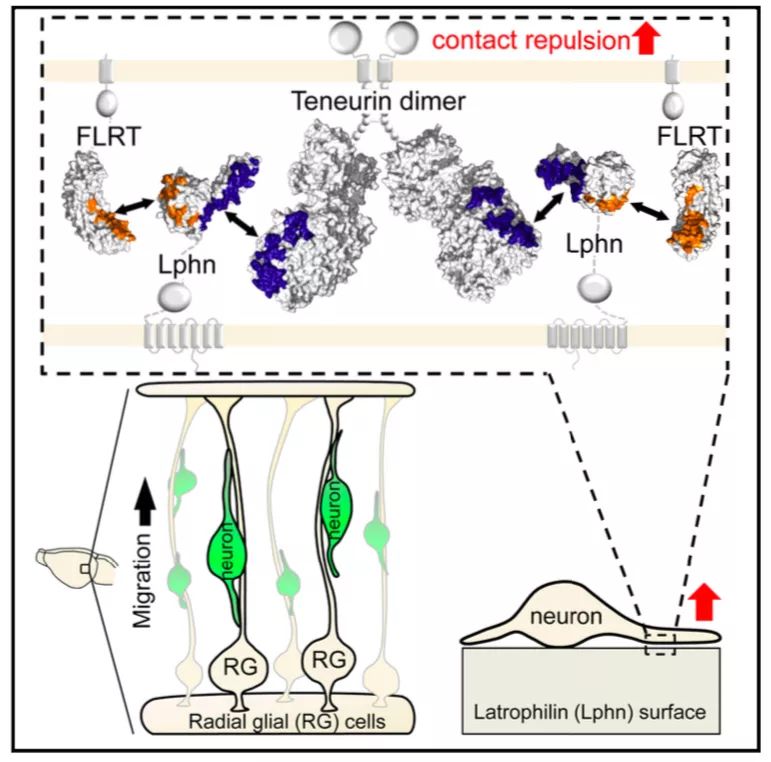
总的来说,文章通过结构解析揭示了Teneurin-Lphn-FLRT三者之间相互作用的基础,并证明了三者之间产生接触排斥从而指导神经元迁移,为我们理解大脑发育提供了新的视角。
原文链接:
https://doi.org/10.1016/j.cell.2019.12.014
参考文献
1. Li, H., Bishop, K.M., and O’Leary, D.D. (2006). Potential target genes of EMX2 include Odz/Ten-M and other gene families with implications for cortical patterning. Mol. Cell. Neurosci. 33, 136–149.
2. Jackson, V.A., del Toro, D., Carrasquero, M., Roversi, P., Harlos, K., Klein, R., and Seiradake, E. (2015). Structural basis of latrophilin-FLRT interaction. Structure 23, 774–781
3. Boucard, A.A., Maxeiner, S., and Su ̈ dhof, T.C. (2014). Latrophilins function as heterophilic cell-adhesion molecules by binding to teneurins: regulation by alternative splicing. J. Biol. Chem. 289, 387–402.
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652479820&idx=3&sn=1c9b32688ef1cdb4af6b9c1f81dad400&chksm=84e232f8b395bbee5791161a31aba1830a38183fce4b55ab4a0069f79c1540ff9fcea67fe088&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



