来源:BioArt
“未定潜能的克隆性造血”(Clonal hematopoiesis of indeterminate potential,CHIP),也称为”与年龄相关的克隆性造血” (Age-related clonal hematopoiesis, ARCH),是由单个突变的造血干细胞和祖细胞 (HSPC) 在人体衰老过程中导致的造血系统中突变克隆比例显著增长 【1-4】。CHIP在健康老年个体中很常见,并且与血液肿瘤的风险增加有关,包括骨髓增生异常综合征(MDS)和急性骨髓性白血病(AML)【1-4】。CHIP也与全因死亡率和心血管疾病风险增加有关【1-4】。大多数CHIP个体携带血液恶性肿瘤相关基因突变,包括DNMT3A、TET2、ASXL1、JAK2和TP53【1-4】。TP53基因编码肿瘤抑制蛋白p53,在CHIP中该基因突变发生率名列前五。TP53体细胞突变存在于10%的MDS和AML病例中;30%的继发性MDS和AML患者在放疗或化疗后出现TP53突变【5-6】。这些研究表明在CHIP中发现的TP53突变可能推动疾病发展,但这些突变在造血干细胞中的作用及机制尚不清楚【1-6】。
2019年12月11日,印第安纳大学刘岩博士实验室与宾夕法尼亚州立大学高中华博士实验室在 Nature Communications 上发表了一篇题为: Mutant p53 drives clonal hematopoiesis through modulating epigenetic pathway的文章。他们发现在骨髓移植实验中,携带TP53突变的造血干细胞与正常造血干细胞相比有更强的竞争优势,并且电离辐射大幅增加了p53突变细胞的扩增潜能。在机制上,突变p53与表观遗传调节蛋白EZH2相互作用,增强其与染色质的结合,从而增加H3K27me3水平促进造血干细胞自我更新。因此,他们揭示了突变型p53通过调节表观遗传修饰驱动克隆性造血,以此增强具有致癌潜力的造血干细胞的竞争优势【7】。

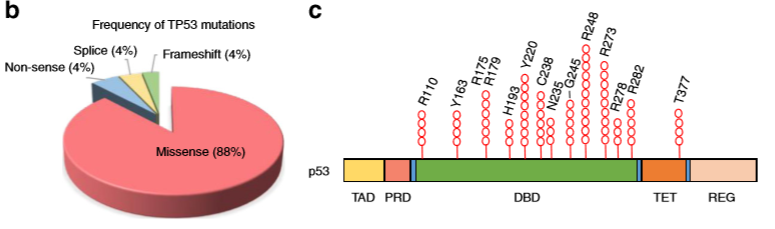
在CHIP中,大约90%的体细胞TP53突变是p53蛋白DNA结合域(DBD)中的错义突变,其中最频繁变异的突变热点(hotspot)-位于氨基酸的248位,其次是273、220和175位【1-4】。联合团队发现, TP53基因错义突变增强了体外和体内的造血干细胞自我更新和再殖能力。临床研究显示,携带特定突变的造血克隆在个体中随着时间进程而扩增【1-4】。然而,不同的细胞压力因素如何影响克隆扩张在很大程度上是未知的。最近,两种不同的选择压力,包括骨髓移植和化疗已被证明能扩增具有致癌潜力的造血克隆【8-9】。事实上,作者发现,在CHIP个体中发现的TP53突变在骨髓移植实验中为造血干细胞提供竞争优势。此外,他们还发现TP53突变促进HSPC在辐射后的存活【7】。
异常的表观遗传调控与造血干细胞老化和血液恶性肿瘤的发病机制有关【10】。为了探究携带p53突变的造血干细胞如何获得竞争优势,作者首先通过RNA-seq发现,与正常造血干细胞相比,Ezh2靶基因表达在有p53突变的造血干细胞中显著降低。研究团队观察到p53突变的造血干细胞中H3K27me3水平增加;ChIP-seq分析也验证了这一结果。研究人员进一步阐述了突变型p53蛋白与表观遗传调节蛋白EZH2相互作用,并增强其与染色质的结合,从而提高了H3K27me3水平,以此调节与造血干细胞自我更新和分化相关的基因表达【7】。
人类癌症中的大多数TP53基因突变导致p53蛋白的肿瘤抑制功能部分或完全丧失【11】。一些突变的p53蛋白获得新的致癌特性 (Gain of function)。虽然显性抑制效应 (Dominant negative effect) 已被证明在骨髓恶性肿瘤中促进TP53错义突变的选择【12】,但突变型p53的新致癌特性似乎在髓性白血病中发挥重要作用【13】。联合团队发现,突变型p53,而非野生型p53,与EZH2相互作用,并增强H3K27me3水平【7】。该研究为TP53基因突变通过获得新的致癌特性在CHIP和血液恶性肿瘤中发挥关键作用提供进一步的证明。
CHIP是一个新出现的公共卫生问题,至少影响15%20%的70岁以上成年人【1-4】。CHIP与原发性和治疗相关性(therapy-related)血液肿瘤的风险增加相关。它也与增加全因死亡率和心血管疾病的风险相关【1-4】。该团队发现EZH2的遗传和药理抑制降低了携带p53突变的造血干细胞的再植潜力,他们的研究工作将有可能建立表观遗传调节蛋白EZH2作为预防CHIP发展和治疗携带TP53突变的血液恶性肿瘤的新治疗靶点。
刘岩博士和高中华博士为此项研究的共同通讯作者。第一作者陈思思博士(下图第一排右一)在刘岩教授(下图第二排右二)实验室获得印第安纳大学医学院的博士学位,现于斯隆凯特林癌症中心 (Memorial Sloan Kettering Cancer Center) 的Omar Abdel-Wahab 实验室接受博士后培训。刘岩博士领导的实验室位于美国印第安纳大学医学院,该实验室一直致力于研究p53在正常造血系统和恶性血液肿瘤中的作用。刘岩团队发现野生型p53可维持造血干细胞的静止状态 (quiescence) ,并鉴定Necdin为p53靶基因并调节HSC中的DNA损伤反应(Liu et al., Cell Stem Cells, 2009)。近年来刘岩实验室发现基因毒性应激 (genotoxic stresses) 促进p53突变的造血干细胞的扩增(Chen et al., Leukemia, 2018),突变型p53通过增强白血病干细胞自我更新驱动白血病的产生 (Nabinger et al., Leukemia, 2019)。
原文链接:
https://www.nature.com/articles/s41467-019-13542-2.pdf
参考文献
1. Steensma, D.P. et al. Clonal hematopoiesis of indeterminate potential and its distinction from myelodysplastic syndromes. Blood 126,9-16 (2015).
2. Genovese, G. et al. Clonal hematopoiesis and blood-cancer risk inferred from blood DNA sequence. N. Engl. J. Med. 371, 2477-87 (2014).
3. Jaiswal, S. et al. Age-related clonal hematopoiesis associated with adverse outcomes. N. Engl. J. Med. 371, 2488-98 (2014).
4. Xie, M. et al. Age-related mutations associated with clonal hematopoietic expansion and malignancies. Nat. Med. 20, 1472-8 (2014).
5. Bejar, R. et al. Clinical effect of point mutations in myelodysplastic syndromes. N. Engl. J. Med. 364, 2496-506 (2011).
6. Rücker, F.G. et al. TP53 alterations in acute myeloid leukemia with complex karyotype correlate with specific copy number alterations, monosomal karyotype, and dismal outcome. Blood 119, 2114-21 (2012).
7. Chen, S. et al. Mutant p53 Drives Clonal Hematopoiesis through Modulating Epigenetic Pathway. Nature Communications. 10(1):5649 (2019).
8. Wong, T.N. et al. Cellular stressors contribute to the expansion of hematopoietic clones of varying leukemic potential. Nat. Commun. 9, 455 (2018).
9. Coombs, C.C. et al. Therapy-Related Clonal Hematopoiesis in Patients with Non-hematologic Cancers Is Common and Associated with Adverse Clinical Outcomes. Cell Stem Cell 21,374-382.e4 (2017).
10. Bejar, R. et al. Clinical effect of point mutations in myelodysplastic syndromes. N. Engl. J. Med. 364, 2496-506 (2011).
11. Brosh, R. & Rotter, V. (2009). When mutants gain new powers: news from the mutant p53 field. Nat. Rev. Cancer. 9, 701-13 (2009).
12. Boettcher, S. et al. A dominant-negative effect drives selection of TP53 missense mutations in myeloid malignancies. Science 365,599-604 (2019).
13. Loizou, E. et al. A Gain-of-Function p53-Mutant Oncogene Promotes Cell Fate Plasticity and Myeloid Leukemia through the Pluripotency Factor FOXH1. Cancer Discov. 9,962-979 (2019).
来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652479234&idx=4&sn=f22b19e0eea36d8fc5c0adad60698ee9&chksm=84e20cb6b39585a06b91ff3322480a9bec2725614a995067cb2a852b40d371a25110d0cb9221#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



