来源:生物通
原标题:INTEGRATE!升级版转座子CRISPR-Cas系统电镜图揭示如何精准插入大片段DNA
哥伦比亚大学的研究团队在霍乱弧菌中发现了一个独特的“跳跃基因”(转座子)后,开发了一种名为INTEGRATE的工具,可以在基因组中精准位置插入大片段基因而不引入DNA断裂。对于侧重于敲除和降解目标DNA、且屡受到脱靶困扰的CRISPR技术,这种新的、精准插入大片段的基因编辑工具有望提供重要的补充。
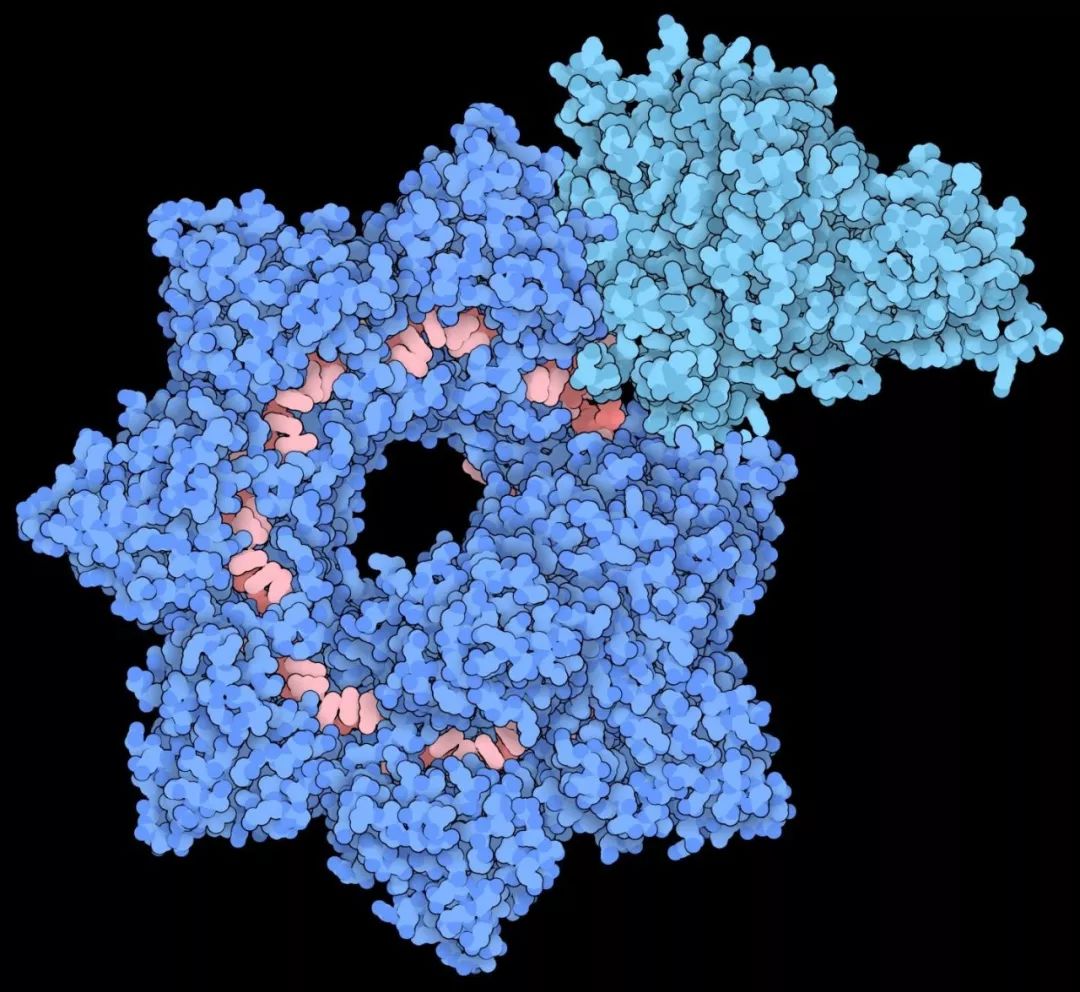
CRISPR技术的应用前景和限制,极大地推动了科学家们研究改良各种基因编辑工具的热情。哥伦比亚大学的研究团队在霍乱弧菌中发现了一个独特的“跳跃基因”(转座子)后,开发了一种名为INTEGRATE(“Insertion of transposable elements by guide RNA-assisted targeting.”缩写,引导RNA辅助靶向的转座元件插入)的基因编辑工具,可以在基因组中插入大片段基因而不引入DNA断裂。在今天发表在《 Nature》杂志上的新研究中,研究人员利用冷冻电镜技术,揭示了INTEGRATE的基因编辑复合体的高分辨率细节图像,有助于揭示其工作原理。这是科学家捕获这种新的基因编辑工具的第一张图像,有望改进现有的基于CRISPR的工具。
开始像CRISPR,但结局不同
面对病原体攻击时,细菌利用CRISPR和Cas基因编码的适应性免疫系统来保持基因组完整性。I型CRISPR-Cas系统通常通过核糖核蛋白复合体Cascade和解旋酶——核酸酶Cas3的联合作用靶向外源DNA,并使之降解。研究人员利用缺少Cas3的核酸酶缺陷型I系统、结合一个来自霍乱弧菌的Tn7样的转座子(Tn6677),实现了由引导RNA辅助的大片段DNA精准插入(而不是降解失活)。
为进一步了解CRISPR与转座子相关的机制如何在DNA靶向和插入过程中协同工作,研究人员使用冷冻电镜的技术,在液氮中快速冷冻由霍乱弧菌Tn6677转座子编码的TniQ–Cascade复合物的样品并用电子轰击,在电子显微镜下捕获的图像生成TniQ–Cascade的原子分辨率模型,从而有助于揭示这种功能性偶联的机理基础。
低温电镜图实现了对转座蛋白TniQ的从头建模和完善细化——TniQ蛋白以二聚体头尾相接的形式与Cascade复合物结合,结合到靠近CRISPR RNA(crRNA)3'端、Cas6和Cas7形成的界面。天然Cas8–Cas5融合蛋白则结合到5'crRNA端,并通过可变的插入域与TniQ二聚体接触。靶DNA结合结构揭示了PAM(protospacer-adjacent motif)识别和R环形成所必需的关键相互作用。这项工作为从结构上了解TniQ–Cascade的DNA靶向如何在后继募集下游转座酶蛋白质奠定了基础,并将为今后在基因组工程应用中如何利用该系统进行可编程DNA插入提供蛋白质设计上的指引。
结构模型表明,该复合物由两个主要部分组成,排列成螺旋形丝状。较大的部分称为Cascade,缠绕起来并携带一段引导RNA——这是用来扫描细胞以寻找DNA中的匹配序列。一旦它定位并结合到靶序列上,它将引导DNA链穿过位于复合物末端的TniQ“转座”蛋白,并募集其他有助于修饰DNA的酶。
INTEGRATE的扫描机制与其他CRISPR系统类似(部分CRISPR系统也包含带有引导RNA的Cascade复合体)。但是不同之处在于,CRISPR系统使用Cascade靶向DNA进行切割,而INTEGRATE中Cascade的功能是靶向DNA以便高精度插入DNA。
在他们之前的研究中,Sternberg及其同事使用遗传学和生物化学方法提出了CRISPR机制如何与转座机制——负责基因“跳跃”的分子——进行功能连接,这项研究证明了他们的假设是正确的。
为什么重要
现在,世界各地的许多研究人员都在使用CRISPR-Cas9快速廉价地对细胞基因组进行精确修饰。但是,CRISPR的大多数用法包含切割目标DNA的两条链,然后必须通过宿主细胞自身的机制修复DNA断裂。控制该修复过程仍然是该领域中的主要挑战,并且常常出现无意间将非预期的基因编辑引入了基因组中。此外,现有基因编辑工具在以精确方式插入较大的基因片段时通常效果不佳。提高基因编辑的准确性是研究人员的当务之急,这对于确保使用此技术开发的疗法的安全性至关重要。
由Sternberg实验室开发的新型INTEGRATE系统可以准确地插入大的DNA序列,而无需依靠细胞机制来修复双链。与广泛使用的原始CRISPR-Cas系统相比,INTEGRATE被证明是更准确和有效地进行某些基因修饰的好方法。该新工具还可以帮助科学家在DNA修复活性有限的细胞类型中进行基因编辑——例如神经元,使用CRISPR的尝试相对而言不太成功。
下一步工作
除了能为将来如何利用基因工程继续改良这个系统提供有效信息,这些结构图还突出了一个可能的校对检查点。现有的CRISPR技术经常受困于“脱靶效应”。新结构图揭示了INTEGRATE系统中Cascade和TniQ如何协同工作,以确保仅允许“正中目标”的序列被标记从而进行DNA插入。这个机制可能对CRISPR系统改造具有意义。研究人员计划进一步探索该检查点,以便将来可以成为开发用于疾病的新治疗方法的工具。
“以这种级别(电镜级别)让生物学可视化,确实令人惊奇,甚至可以使那些不熟悉该领域的人都感到兴奋。”哥伦比亚大学欧文医学中心细胞,分子和生物物理研究专业的博士生Tyler Halpin-Healy说,他是该研究的第一作者。
哥伦比亚大学生物化学与分子生物物理学助理教授Sam Sternberg博士说:“这些新图像。。。以令人难以置信的分子细节解释了生物学,有望通过指导如何进行蛋白质工程改造来帮助改良这一系统。”
来源:gh_c1fce5726992 生物通
原文链接:https://mp.weixin.qq.com/s?__biz=MjM5NzMwNjYyMg==&mid=2675531750&idx=2&sn=4de79a3303503fb26247a9e2a59a959c&chksm=bc51f6778b267f6159506ab289b2eb88474d94944130c901e30d549d619de95dcb2c29be34de#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



