来源:BioArt
责编 | 兮
放疗和化疗是当前癌症治疗的主要方法。在放化疗后进行骨髓或造血干细胞(Hematopoietic Stem Cell, HSC)移植,广泛应用于多种恶性血液疾病的治疗【1】。然而,HSC数量极为稀少,数量不足的HSC移植可能会导致骨髓移植效率低下。低移植效率会引起病人免疫系统再生缓慢,从而导致其它病发症的出现,甚至移植失败。因此,提高骨髓移植效率的研究具有潜在临床应用价值。
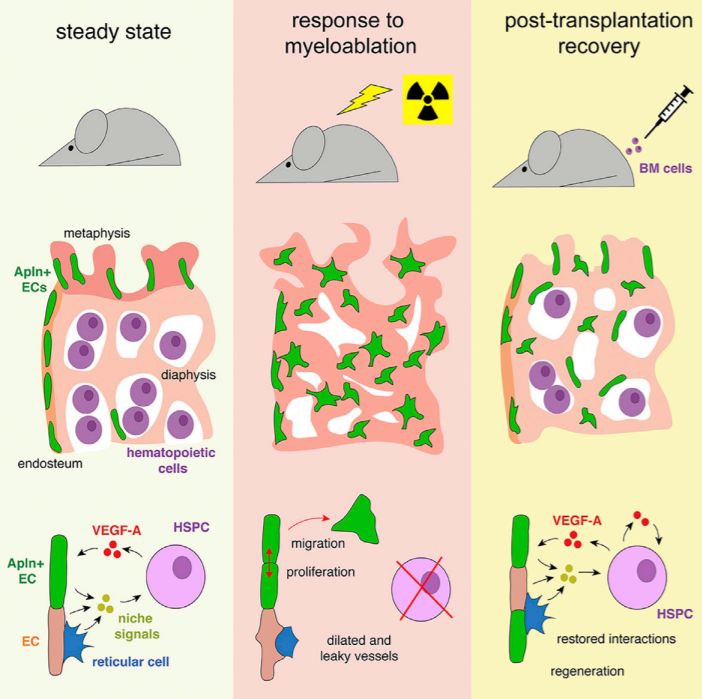
在成年哺乳动物中,HSC主要存在于骨髓中。HSC的维持,静息,增殖和运动等行为受到其微环境“龛”(Niche)的调控【2,3】。组成龛的多种细胞被认为具有调控HSC的功能,特别是血管内皮细胞(Endothelial Cell, EC)和血管旁细胞【4】。前期工作表明,放疗和化疗会导致骨髓血管的损伤【5,6】。然而,对于(1)放化疗引起的骨髓血管损伤的特征和机制,(2)骨髓血管如何再生,(3)靶向骨髓血管是否可以促进骨髓移植效率提高等问题,至今仍不清楚。
近日,德国马克斯·普朗克分子生物医学所的Ralf H. Adams团队(共同一作为陈奇和刘阳博士)在Cell Stem Cell杂志上发表文章 Apelin+ Endothelial Niche Cells Control Hematopoiesis and Mediate Vascular Regeneration after Myeloablative Injury,报道了一群Apelin (Apln)阳性的血管内皮细胞,在生理状态下调控HSC和造血,在骨髓移植过程中促进骨血管再生和血细胞重建。在同期的Cell Stem Cell杂志上,还发表了对这项工作的专门介绍文章 Mutualism in the Marrow 。

研究者首先鉴定放疗(全身辐射)和化疗(5-氟尿嘧啶)引起的骨血管损伤的特性,发现辐射和化疗药物处理导致Endomucin标记的血管面积大幅增加,在单细胞水平上血管内皮细胞形态发生显著变化,血管内皮细胞密度显著增加,并非之前文献暗示的血管内皮细胞会在放疗或化疗之后数量减少。通过测序,研究者发现辐射还导致血管内皮细胞的基因转录水平发生剧烈动态变化。研究者还发现放化疗引起的血液细胞的消除,特别是血液干细胞和前体细胞(Hematopoietic stem and progenitor cells, HSPC)的消除,是导致这些骨血管损伤的原因。
进一步的,研究者鉴定到一群表达Apelin (Apln) 的血管内皮细胞(Apln+ EC)。这些Apln+ EC具有独特的分布特征和分子特性。Apln+ EC的移除会导致HSC数量和百分比降低,骨髓和外周血中淋巴细胞减少,外周血和肝脏中髓系细胞(myeloid cells)增加,骨髓移植效率显著降低等现象。在辐射和骨髓移植后,Apln+EC具有分化为动脉血管内皮细胞和大量骨干 (Diaphysis) 血管内皮细胞的能力。研究者还发现,并不是所有的血管内皮细胞都在移植后的骨血管再生中起到重要作用,例如动脉血管内皮细胞和Esm1+的血管内皮细胞在骨血管再生中没有明显贡献。Esm1+血管内皮细胞在HSC维持,造血和骨髓移植中都没有显著作用。这表明,并不是所有的血管内皮细胞都具有龛的功能。
最后,研究者发现,HSPC是骨髓中血管内皮细胞生长因子A(Vascular endothelial cell growth factor A, VEGF-A)的主要来源。HSPC可以释放VEGF-A,直接作用在Apln+ EC上,影响骨血管再生和血细胞重构的效率。在骨髓移植过程中额外提供外源性的VEGF-A,可以提高骨血管再生和骨髓移植的效率。外源性VEGF-A的注入,可以改变骨血管内皮细胞的性质,将普通骨血管内皮细胞转化成具有龛功能的Apln+ EC。
综上,在这项工作中,研究者发现了HSPC对骨血管内皮细胞维持的作用,鉴定了一种亚群Apln+血管内皮细胞具有调控HSC和造血的重要功能,提示存在有趣的细胞之间互利共生关系,以及外源性VEGF-A可以作为潜在的治疗靶点用于提高骨髓移植效率。
据悉,Ralf H. Adams的实验室主要从事血管内皮细胞多样性,骨血管内皮细胞在成骨和造血过程中的作用等领域的研究。文章的共同第一作者陈奇和刘阳毕业于中国科学院上海生命科学院神经科学研究所。该工作得到了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)的周斌研究员的大力支持。
原文链接:
https://www.cell.com/cell-stem-cell/fulltext/S1934-5909(19)30427-8
https://www.cell.com/cell-stem-cell/fulltext/S1934-5909(19)30462-X
参考文献
1. Morgan, R.A., Gray, D., Lomova, A., and Kohn, D.B. (2017). Hematopoietic Stem Cell Gene Therapy: Progress and Lessons Learned. Cell Stem Cell 21, 574-590.
2. Crane, G.M., Jeffery, E., and Morrison, S.J. (2017). Adult haematopoietic stem cell niches. Nat Rev Immunol 17, 573-590.
3. Pinho, S., and Frenette, P.S. (2019). Haematopoietic stem cell activity and interactions with the niche. Nat Rev Mol Cell Biol.
4. Ding, L., Saunders, T.L., Enikolopov, G., and Morrison, S.J. (2012). Endothelial and perivascular cells maintain haematopoietic stem cells. Nature 481, 457-462.
5. Hooper, A.T., Butler, J.M., Nolan, D.J., Kranz, A., Iida, K., Kobayashi, M., Kopp, H.G., Shido, K., Petit, I., Yanger, K., et al. (2009). Engraftment and reconstitution of hematopoiesis is dependent on VEGFR2-mediated regeneration of sinusoidal endothelial cells. Cell Stem Cell 4, 263-274.
6. Zhou, B.O., Ding, L., and Morrison, S.J. (2015). Hematopoietic stem and progenitor cells regulate the regeneration of their niche by secreting Angiopoietin-1. Elife 4, e05521.
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652479099&idx=4&sn=05fcff45982eec6a12799509fc168332&chksm=84e20dcfb39584d9145ad3bcdf061ef16f09293fb827bcf3eae94329ef4dba49a274bf60931d&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



