来源:iNature
嗜肺军团菌效应子MavC通过转谷氨酰胺化诱导E2泛素结合酶UBE2N泛素化,从而消除了其在K63型多聚泛素链合成中的功能。对UBE2N活性的抑制产生了一个难题,因为该E2酶在多种信号通路中很重要,包括一些对于细胞内嗜肺军团菌复制很重要的通路。
近期,福建师范大学欧阳松应和普渡大学罗招庆共同通讯在The EMBO Journal 在线发表题为“Legionella pneumophila regulates the activity of UBE2N by deamidase‐mediated deubiquitination”的研究论文,该研究显示了MavC对UBE2N活性的长期抑制会限制细胞内细菌的复制,并且MvcA是MavC的直系同源物(泛素脱酰胺酶活性)(50%相同),恢复了UBE2N的活性。MvcA-UBE2N-Ub复合体的结构分析揭示了MvcA中插入域在底物识别中的关键作用。这一研究不仅揭示了谷酰胺脱氨酶的全新功能,也表明结构高度相似的两个蛋白可以具有截然相反的生化功能,对后续探讨蛋白功能进化以及结构和功能的关系具有重要意义。
另外,2019年7月22日,福建师范大学欧阳松应与美国普渡大学罗招庆共同通讯在Nature 在线发表了题为“Regulation of phosphoribosyl ubiquitinationby a calmodulin-dependent glutamylase”的研究论文,该研究发现致病性嗜肺军团菌(Legionella pneumophila)效应蛋白SidJ可以被宿主体内的一个钙调蛋白Calmodulin(简称CaM)结合并激活,进而通过谷氨酸化修饰(Glutamylation)抑制SidE家族泛素连接酶活性的分子机理。该工作详细解析了致病性嗜肺军团菌效应蛋白SidJ调控SidE酶活性的分子机制,为探讨谷氨酸修饰酶(glutamylase)的催化机制提供了新的体系,也为临床治疗嗜肺军团菌感染的药物开发提供了新靶点
2019年6月11日,福建师范大学欧阳松应团队在Nature Communications 在线发表题为“Two HEPN domains dictate CRISPR RNA maturation and target cleavage in Cas13d”的研究论文,该研究为进一步改造Cas13d蛋白作为核酸编辑及检测工具,提供了扎实的结构基础和理论依据;
2018年11月13日,福建师范大学欧阳松应团队在Cell Research 在线发表“Structural insights into Cas13b-guided CRISPR RNA maturation and recognition”,该成果对认识与理解细菌抵抗RNA病毒入侵的分子基础具有重要意义,为改造CRISPR-Cas13b系统其在RNA识别与编辑、核酸检测领域的应用提供了结构生物学基础(点击阅读);
2018年7月1日,福建师范大学欧阳松应等团队在Structure上在线发表了题为“Crystal Structure of ATP-Bound Human ABCF1 Demonstrates a Unique Conformation of ABC Proteins”的研究论文,该研究分析了一个结合ATP的野生型人源ABCF 1的晶体结构(2.3-Å分辨率)。比较研究表明,该结构为预激活中间构象。这种构象是通过ATP与蛋白质的相互作用来稳定的。同时该研究也表明,这种构象是激活ABCF 1的一个重要步骤。本研究从分子水平扩展了我们对ABC蛋白激活的理解。

泛素化修饰调控真核细胞中几乎所有的过程,尤其在细胞分裂和免疫反应等方面起不可或缺的作用。很多病原菌成功感染宿主的前提是高效干扰和劫持泛素化和去泛素化调控的寄主细胞过程。嗜肺军团菌是一种可引起人类的非典型性肺炎的条件性致病菌, 其通过一个称为Dot/Icm的IV型分泌系统分泌大约330个效应蛋白到宿主细胞中,这些毒力蛋白利用高度多样化的生化机制干扰宿主各种信号通路以辅助细菌在宿主细胞内的增殖。
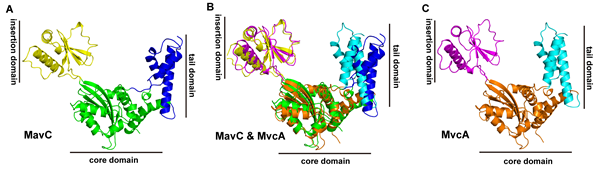
图1 MavC 和MvcA结构及其比较。A和C分别是MavC和MvcA的晶体结构(PDB:5TSC和6K11)。它们的tail,core 和insetion 区域分别用不同颜色标明。B为MavC和MvcA结构重叠图。
前期研究发现嗜肺军团菌的效应蛋白MavC以谷氨酰胺转胺酶方式催化泛素分子的Gln40与E2结合酶UBE2N的K92和K94位点形成异肽键,从而完成对UBE2N的泛素化修饰并抑制其功能。UBE2N主要参与合成K63型的多聚泛素链,在免疫反应和细胞生存等过程中起重要作用。在感染过程中,NF-kB参与维持感染细胞的生存,而MavC介导的UBE2N泛素化会持续抑制其功能,导致NF-kB活性下降,引起感染细胞死亡,不利于军团菌在胞内的增殖。

图2 MavC 和MvcA 在军团菌感染过程中的作用模型。感染初期,MavC 抑制UBE2N的活性从而逃逸感染导致的免疫激活。进入胞内生长期后,表达分泌MvcA对UBE2N-Ub去泛素化修饰,恢复UBE2N的活性,维持感染细胞存活,从而病菌能继续繁殖。
这项研究揭示位于mavC下游的mvcA基因编码一个能特异性的对UBE2N-Ub去泛素修饰的酶。令人意外的是,MvcA和MavC在蛋白系列和结构上高度相似(图1),并且均具有泛素脱酰胺酶功能。通过解析MvcA与其底物UBE2N-Ub复合物的高分辨率晶体结构,研究者我们发现MvcA的一个插入区域参与了底物识别。经MvcA去泛素的UBE2N恢复其E2泛素结合酶的功能,重新参与NF-kB通路的激活,保证感染细胞存活,从而支撑细菌在胞内的生长。
该研究还发现MavC在整个感染过程中表达水平保持一致,而MvcA只有在感染后5小时才能在胞内菌中检测到表达,表明军团菌通过控制MavC和MvcA在感染过程中的表达,满足在不同时间段感染细胞对UBE2N功能的需求(图2)。这一研究不仅揭示了谷酰胺脱氨酶的全新功能,也表明结构高度相似的两个蛋白可以具有截然相反的生化功能,对后续探讨蛋白功能进化以及结构和功能的关系具有重要意义。
据悉,福建师范大学欧阳松应教授和普渡大学罗招庆教授为本文的共同通讯作者,福建师范大学欧阳松应课题组副研究员关洪鑫和普渡大学罗招庆课题组博士研究生干宁海是共同第一作者,欧阳松应教授课题组硕士研究生黄旖旎、余婷和普渡大学罗招庆课题组付嘉琦等参与部分工作,本项目研究也获得生科院王冬梅老师的大力支持。
参考消息:
https://www.embopress.org/doi/10.15252/embj.2019102806
来源:Plant_ihuman iNature
原文链接:http://mp.weixin.qq.com/s?__biz=MzU3MTE3MjUyOA==&mid=2247506207&idx=6&sn=07ba089af68a54b3f1325b403729797f&chksm=fce6aac0cb9123d6220b11849f4b6a6aacd090c9ab84c67ffbde788094a2d33ff0a3abdd69c5&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



