蛋白精氨酸甲基转移酶(PRMT)家族是一类可将精氨酸胍基上氮原子进行单甲基和双甲基修饰的酶类,根据甲基化产物不同,主要分为I型和II型。目前在哺乳动物中只发现9个成员。早期研究发现它们能够使组蛋白甲基化,从而影响基因转录、细胞增殖分化等生物学过程。随着组学等技术发展,越来越多的非组蛋白也被鉴定出含有甲基化精氨酸。但是,由于缺乏可靠的抗体以及机制明确的“eraser”和“reader”,很大程度上限制了精氨酸甲基化的分子机制和生物学功能研究。
中国科学院上海营养与健康研究所(中国科学院-马普学会计算生物学伙伴研究所)王泽峰研究组近期在Science Bulletin在线发表了题为“A systematic survey of PRMT interactomes reveals the key roles of arginine methylation in the global control of RNA splicing and translation”的研究论文。该研究应用蛋白质组学技术系统性鉴定了人类细胞中已知的所有9个PRMT的互作蛋白,并利用多种测序技术,结合生物信息学分析,证明了PRMT在mRNA剪接和翻译中扮演重要功能。
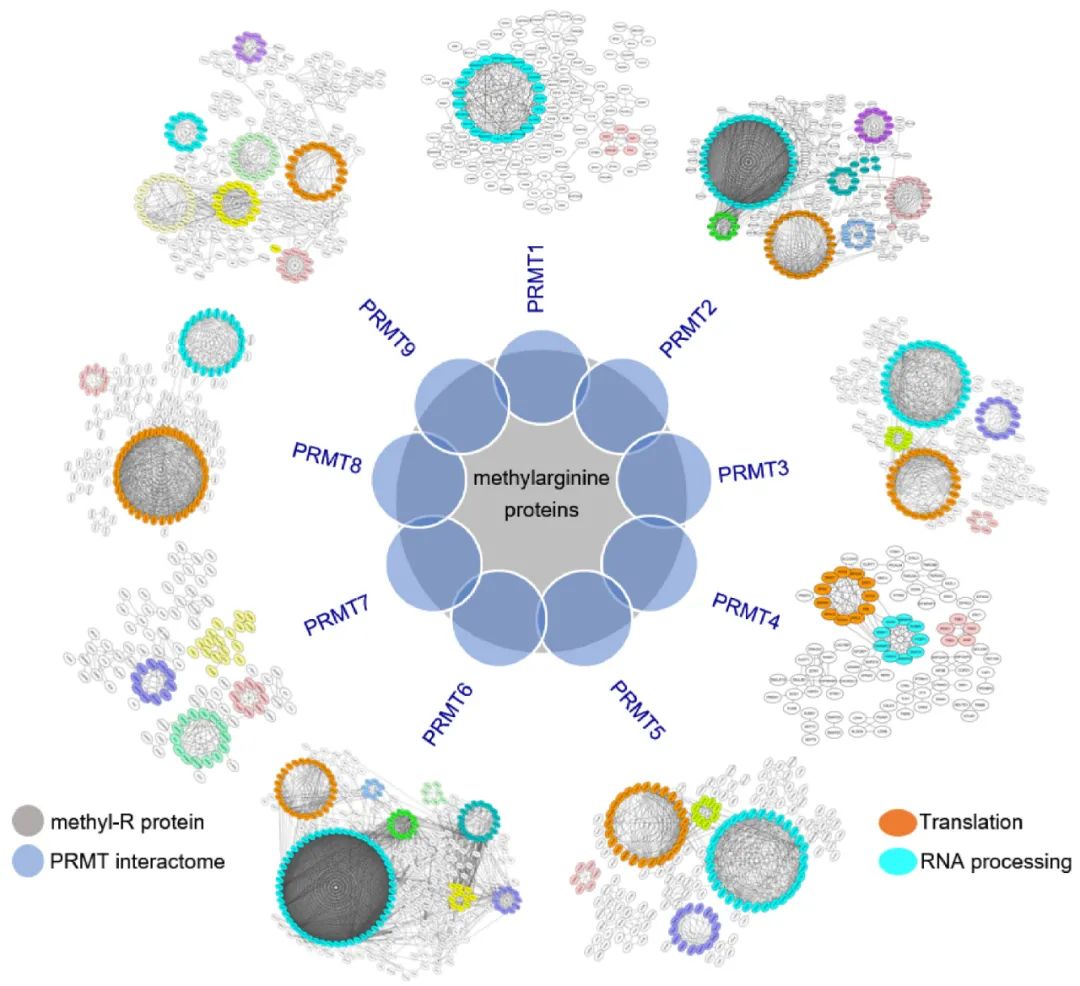
研究人员首先通过BioID结合非标定量质谱技术,系统性鉴定了人类9个PRMT的互作组,结果显示PRMT互作组与已知的含甲基精氨酸的蛋白质高度重叠;且不同PRMT之间有补偿效应,主要表现为它们底物之间显著重叠,并且底物甲基化基序也具有高度相似性。该研究用计算生物学方法鉴定了一些新的可能的甲基化基序,并用体外甲基化实验进行了验证。
通过对PRMT互作组进行生物信息学分析,研究者发现PRMT的催化底物主要是参与了mRNA剪接和翻译的RNA结合蛋白(RBP),并且这些RBP含有高度富集的精氨酸甲基化区域。特别值得一提的是,研究者发现核糖体核心蛋白含有大量的精氨酸甲基化修饰。
研究者接着用shRNA或者PRMT特异性抑制剂分别抑制PRMT活性。通过RNA-seq测序,发现抑制PRMT活性可以广泛地改变可变剪接,并且各PRMT调控的剪接事件也高度重合。研究者又利用核糖体蔗糖密度梯度离心法,分离得到核糖体保护的mRNA并进行测序,发现抑制PRMT活性也抑制了mRNA翻译。随后研究者对核糖体保护的mRNA实行消化并进行Ribo-seq,观察到PRMT活性抑制并没有改变核糖体在mRNA不同区域的分布,提示核糖体很可能在成熟前的组装过程中已经受到了影响。
最后,研究者用核糖体蛋白RPS2为例,展示了核糖体蛋白的精氨酸甲基化对核糖体组装非常重要,这可能是PRMT影响翻译的主要分子机制。
该研究系统性地将每个PRMT和精氨酸甲基化事件联系起来,并提供了PRMT生物学功能的新见解,揭示了精氨酸甲基化在RNA加工和翻译调控中的关键功能。我们期望这项研究中的新发现和数据分析方法引起蛋白质修饰和RNA生物学领域研究者的广泛兴趣,从而促进精氨酸甲基化领域的发展。
中科院上海营养与健康所王泽峰研究员为文章通讯作者,魏欢欢博士为本文第一作者和共同通讯作者。上述研究工作得到科技部国家重点研发计划、国家自然科学基金委员会和上海市科学技术委员会等科研经费的支持。
来源:中国科学杂志社
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQ5MzQyNA==&mid=2656811107&idx=2&sn=30a88a5c645861849cdab0f4161452b4
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn


