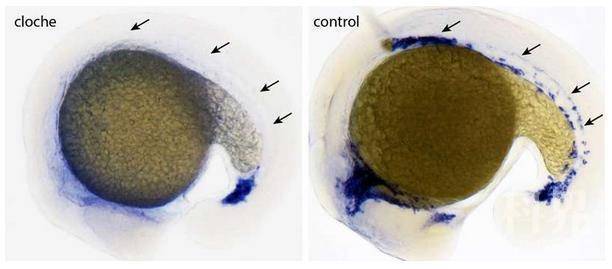
这个基因,全世界的研究者们对其进行了长达十年的探寻,展现出了科学的迷人之处。它就是控制胚胎形成血液和血管的关键基因。自来自Bad Nauheim马克斯普朗克心肺研究所发育遗传学系的Didier Stainier主任发现一个名为“cloche”的斑马鱼突变体以来,已经过去了20多年。这种突变体缺乏血管和血细胞的形成,并且直到现在仍是一种独特的现象。现在,他的研究小组已经成功找到了导致此现象的基因。它似是将自己隐藏在了13号染色体的末端,研究人员采用了最新的分子生物学方法才发现它。该基因的发现不仅体现了科学的有趣,对再生医学也可能有着重要意义。
Didier Stainier精彩演说,猛戳视频↓↓↓
第一部分:
第二部分:
第三部分:
在胚胎发育的一个很早期阶段,血管和血细胞由共同的祖细胞形成。血液和血管形式的时机和方式受到由多个基因参与的基因程序的调节。这个程序的特点是一个级联样活动模式。在九十年代中期,来自Bad Nauheim马克斯普朗克心肺研究所发育遗传学系的Didier Stainier主任,在模式生物斑马鱼中发现了一个突变体。“在左右斑马鱼中,它拥有迄今发现的最令人兴奋的发育缺陷,”与Oliver Stone与Alethia Villasenor同为该研究主要作者的Sven Reischauer说道。由于这种鱼的基因变化,关于血液和血管细胞的遗传程序的基因,一个都没被激活。因此,这些细胞不能发育。Stainier还发现该斑马鱼的另一个独有特征—它的心脏是钟形的,因此将此突变体命名为“cloche”(中文意思即为钟形)。一
在过去的二十年中,世界各地的各种实验室都在搜寻这个突变背后的基因。“对我们所有人来说,找到“Cloche”基因,解决这个遗传学问题,就像是几十年的老刑事案件。然而,在这种情况下,未知的不是行为人而是受害人,即那个有缺陷的基因。”Reischauer说。Bad Nauheim马克斯·普朗克研究所的研究人员们B与别国的伙伴们一起成功地完成了这次搜寻。
隐藏在染色体末端的“帽”中
“由于“Cloche”基因位于13号染色体的最末端,研究工作变得极为复杂。”Reischauer说。现在,运用最近才能够运用的方法(例如,CRISPR / Cas9和TALEN),我们才有了能分析这些区域的工具。“此外,我们不得不假设该基因只在明显缺乏血管生长的时间点之前被激活。这使得识别相应胚胎更加困难。”Reischauer.说。
首先,Bad Nauheim的研究者们检测了疑为cloche基因所在基因组的整个部分。对26000个基因的数据分析显示,有17个基因可被视作有希望的候选基因。然后,他们利用基因沉默,分别使这些候选基因失活,并检查这些胚胎的血管生长。” “我们只在一种情况下找到了想要的画面,即血管生长未能诱发。之后我们便相信,我们已经找到了cloche基因”Reischauer说。
在另外的实验中,马克斯普朗克研究所的科学家们发现,Cloche基因对于血管和血细胞在胚胎中的发育是多么重要:先前已知参与血管形成的所有基因,只有在cloche基因被激活后,才能被激活。因此,Cloche基因本身控制着整个基因程序的活性。
这点在所谓的过表达实验已经得到了证实。在此实验中,研究人员将纯化的cloche 基因的mRNA注入胚胎。这种方法使他们能够在原本还未激活的胚胎发育时间点启动血管和血细胞的生成程序。“,因此,我们可以认为我们已经找到了负责控制发育程序的基因。”Stainier说。
Cloche在自然界中似乎是高度保守的:即使在鸟类中,该基因都尚还存在。在哺乳动物中,有一个与Cloche密切相关的基因,可以接管该基因在斑马鱼模型中的功能。因此,Bad Nauheim的科学家们假设“随着该基因及其功能确认,在个性化干细胞疗法的背景下,开发新应用拥有巨大的机遇。”Stainier说。

来源:iBioChina 生物医学大讲堂
原文链接:http://mp.weixin.qq.com/s?__biz=MzA5NDk1NTk2NQ==&mid=2650826188&idx=1&sn=d82f560fdfae024b64dc882924f37f8a
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn