来源:BioArt
责编 | 兮
真核生物细胞核中的染色质拥有较为复杂的三维结构(3D chromatin structure)。在不同的尺度上这些结构呈现出不同的特征。目前学界公认的染色质结构包括但不限于以下几种【1,2】:
(1) 在兆碱基(megabase)尺度上的染色质区室化(chromatin compartmentalization)。在这种结构的描述当中染色质被分为两种一段一段相互间隔的部分即A/B区室(A or B compartments)。其中同种区室容易发生相互作用,而不同种的区室更倾向于相互排斥。因此在Hi-C图谱上,染色质区室呈现出一种棋盘状的结构(如下图)【3】。
(2)在更小的尺度上(通常亚兆碱基-兆碱基)染色质会形成一种叫做染色质拓扑结构域(topologically associated domain,TAD)的结构【4】。这类的结构的特点是结构域内的染色质倾向于相互作用,而属于两个结构域之间的染色质更倾向于不相互作用。因此拓扑结构域在Hi-C图谱上呈现为一个个三角形(如下图)。
(3)在拓扑结构域中可能会出现染色质环(loop)。染色质环是指两片相隔较远的染色质之间形成的环状结构。此类结构非常重要,因为基因在不同组织中的特异性表达就可能会通过其启动子与相隔较远的一个至多个增强子之间形成的染色质环来进行调控。
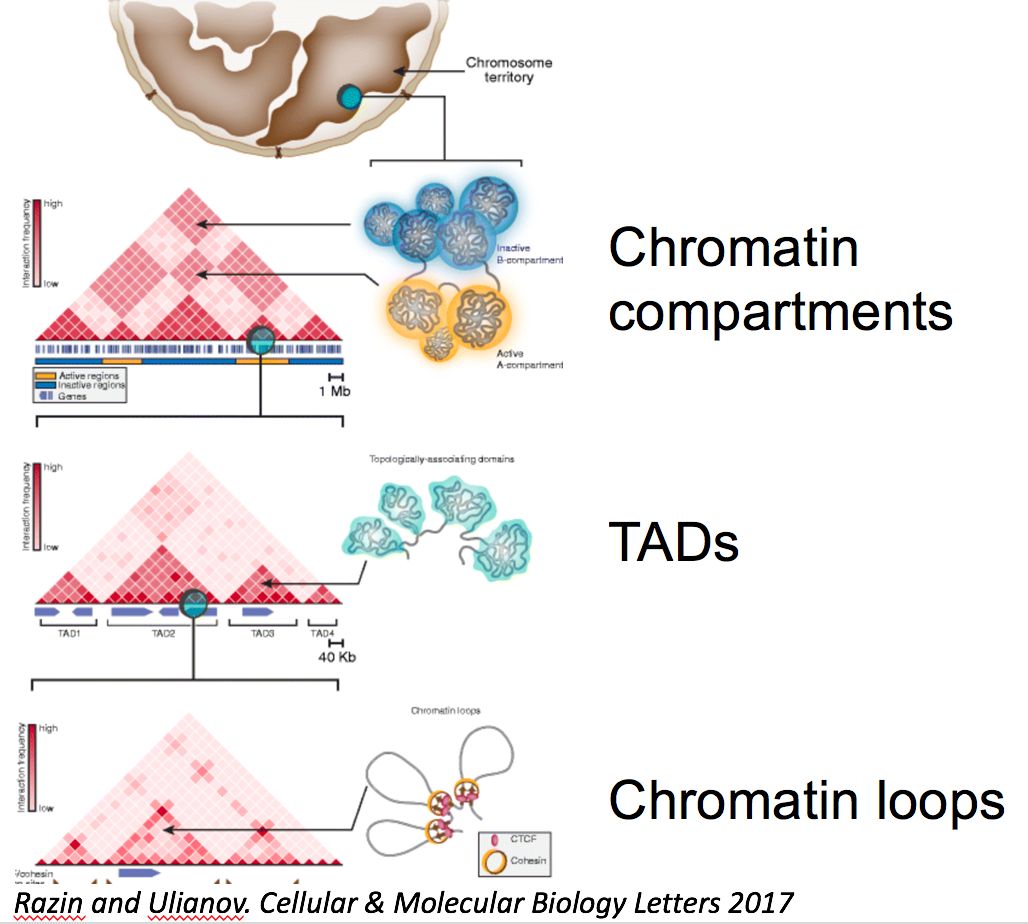
当然以上三种结构是比较笼统的划分,实际上的染色质结构可能要比上面三种更为复杂。三种结构之间的相互位置可能也不仅仅是简单的倒金字塔式的囊括关系【1】。
经过十余年的探索,人们对染色质的三维结构有了比较直观与丰富的了解。然而,在第四维度(时间维度)上染色质的三维结构的动力学变化(chromatin structure dynamics)方面,人们依然了解的相对较少。其中的一个热点就是在细胞周期(cell cycle)的过程当中,染色质的三维结构是怎么变化的。
2013年,Job Dekker实验室发表了一篇Science【5】。在这篇文章中他们第一次描述了细胞在有丝分裂前中期(prometaphase)时的染色质三维结构。他们发现在这个时期,染色质区室以及拓扑结构域均被打乱。2016年,Gerd Blobel实验室发现了myc基因的启动子和增强子之间形成的染色质环也在分裂前中期被完全打乱【6】。而在2018年,Job Dekker实验室又发表了一篇Science文章来描述从G2期到有丝分裂中期染色质结构变化的过程【7】。而染色质从分裂中前期到下一个G1期的三维结构变化还没有被系统研究过。比如:(1)染色质的三维结构是怎样从有丝分裂中前期变化到下一个细胞循环的G1期的(即,各个尺度上的染色质结构是如何重现的)?(2) 在以上过程当中可能参与的调控机制是什么?
2019年11月27日来自于美国费城儿童医院的张浩岳(Haoyue Zhang)和Gerd Blobel以及他们的合作者Jennifer Phillips-Cremins, 在Nature上发表了题为Chromatin structure dynamics during themitosis-to-G1phase transition的论文,描述了从有丝分裂中前期到下一个细胞循环G1期这一阶段染色质三维结构在各个尺度上的变化过程,以及有可能的调控机制。

为了完成以上观察,作者们在一种快速分裂的小鼠成红细胞系G1E-ER4(an erythroblast line)上进行试验。作者们在从有丝分裂前中期到下一细胞循环G1的约4个小时的时间段中截取了5个时间点,分别代表有丝分裂前中期,有丝分裂后/末期,早,中,以及晚G1期。通过流式细胞分选,作者们在各个时间点得到了高度纯净的细胞,然后通过Hi-C描述这些时间点上的细胞染色质结构,从而描述整个过程之中的染色质结构变化。文章主要结论为以下几点:
(1) 在有丝分裂过程中,染色质区室(Chromatin compartments)的重现非常迅速(在有丝分裂后/末期,即开始重现)。然而这个过程并非一蹴而就,整个过程非常动态化。从头到尾,染色质分段的强度持续增强,并且随着时间的推移,相隔极远(>100Mb)的同种染色质片段开始相互作用。
(2)拓扑结构域的重现遵循一个“从下而上”的规律:即结构较小的亚拓扑结构域(subTAD)更早出现,在这基础之上,结构更大的拓扑结构域开始出现。
(3)作为“环挤出”模型(loop extrusionmodel)的两种极为重要的组成因子,染色质结构蛋白CTCF以及cohesin环复合体在整个有丝分裂的过程中展现出非常不同的特性。在有丝分裂中期以后,CTCF会极快地与染色质重新结合,从而为cohesin的归位提供基础。相反,cohesin环复合体加载到染色质上的速度显得更为缓慢。而相应的结构性染色质环(structural loop)的形成速率与cohesin在染色质上的归位速率呈现较好的相关性,从而在侧面印证了“环挤出”模型。
(4)顺式调控原件染色质环是两个顺式调控原件(启动子或增强子)之间形成的环状结构。不同于结构性染色质环,顺式调控原件染色质环的形成可独立于CTCF以及cohesin环复合体。令人惊异的是在有丝分裂后,顺式调控染色质环的形成非常迅速,并且要快于结构性染色质环。另外,在特定的情况下,结构性染色质环有可能抑制(隔离)顺式调控元件之间的相互作用,从而在进入G1期之后打破之前(有丝分裂后/末期)已经形成的顺式调控原件染色质环。
(5)在有丝分裂中期之后,顺式调控原件染色质环的形成速率与相应的基因的转录激活速率呈现正相关性。然而这一阶段的两者之间是否存在因果关系(causation)还有待进一步研究。
总之,本文通过对真核生物细胞有丝分裂过程中各个时段染色体结构的探索,描述了染色体结构在有丝分裂后的重置过程。
本文第一作者为费城儿童医院博士后张浩岳。通讯作者为费城儿童医院与宾夕法尼亚大学的Frank E. Weise III Professor of Pediatrics, Gerd Blobel以及宾夕法尼亚大学工程学院的Jennifer Phillips-Cremins.
原文链接:
https://www.nature.com/articles/s41586-019-1778-
制版人:小娴子
参考文献
1. Rowley, M. J. & Corces, V.G. Organizational principles of 3D genome architecture. Nat. Rev. Genet.(2018). doi:10.1038/s41576-018-0060-8
2. Razin, S. V. & Ulianov, S.V. Gene functioning and storage within a folded genome. Cellular andMolecular Biology Letters 22, (2017).
3. Lieberman-Aiden, E. et al.Comprehensive mapping of long-range interactions reveals folding principles ofthe human genome. Science (80-. ). 326, 289–293 (2009).
4. Dixon, J. R. et al.Topological domains in mammalian genomes identified by analysis of chromatininteractions. Nature 485, 376–380 (2012).
5. Lajoie, B. R. et al.Organization of the Mitotic Chromosome. Science (80-. ). 948,1–10 (2013).
6. C.C.-S., H. et al. Ahyperactive transcriptional state marks genome reactivation at the mitosis-G1transition. Genes Dev. 30, 1423–1439 (2016).
7. Gibcus, J. H. et al. Apathway for mitotic chromosome formation. Science (80-. ). 359,(2018).
来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652478551&idx=2&sn=4f4b503bd709e0c74fcc49bb3619ebc0&chksm=84e20fe3b39586f5024a9504f4c676e0d0101a92cad98a39ec41732c502961588984c069ba7d#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn