来源:BioArt
编译 | 章台柳
责编 | 兮
从受精卵如何发育成为成百种高度特化的细胞类型组成的生物体,一直都是生物学家所追寻的奥秘。不同类型的细胞表达“一套特定组合”的基因,即细胞身份决定。这种基因表达模式需要建立和维持,两个过程既不同又互相关联。初始细胞的多能性和细胞类型的建立依赖于成百个转录因子的协同作用,其与特定的DNA序列结合激活或抑制细胞谱系基因的转录。
在1942年Conrad H. Waddington提出“表观遗传学”概念的初始阶段,所对应的的意思和当今主流定义有别,主要用于描述个体生物发育过程中基因型决定表型的机制。而后续围绕“表观遗传”的定义则是强调不改变DNA序列,对可变化的染色质状态的遗传,这一主流“表观遗传学”概念首先由Nanney D.L提出,然后 Arthur D. Riggs和Holliday推动,Bird等进一步修正得到(1996 年, Arthur D. Riggs 将“表观遗传学”定义为“研究在有丝分裂和/或减数分裂过程中不能用 DNA 序列改变来解释基因功能的可继承性改变”;2008 年,在美国举行的染色质冷泉港会议上, “表观遗传学”被正式定义为“不依赖于 DNA 序列的变化而是由于染色体改变所产生的稳定可遗传的表型”。)。DNA甲基化、染色质蛋白、非编码RNA都是表观遗传信息的重要载体。如组蛋白变体和组蛋白修饰直接或间接地影响染色质结构。同时,高阶3D染色质折叠也可以调控基因表达,有助于遗传。表观遗传研究在21世纪发展迅速,给我们带来兴奋和希望的同时,也产生“过度热议”。
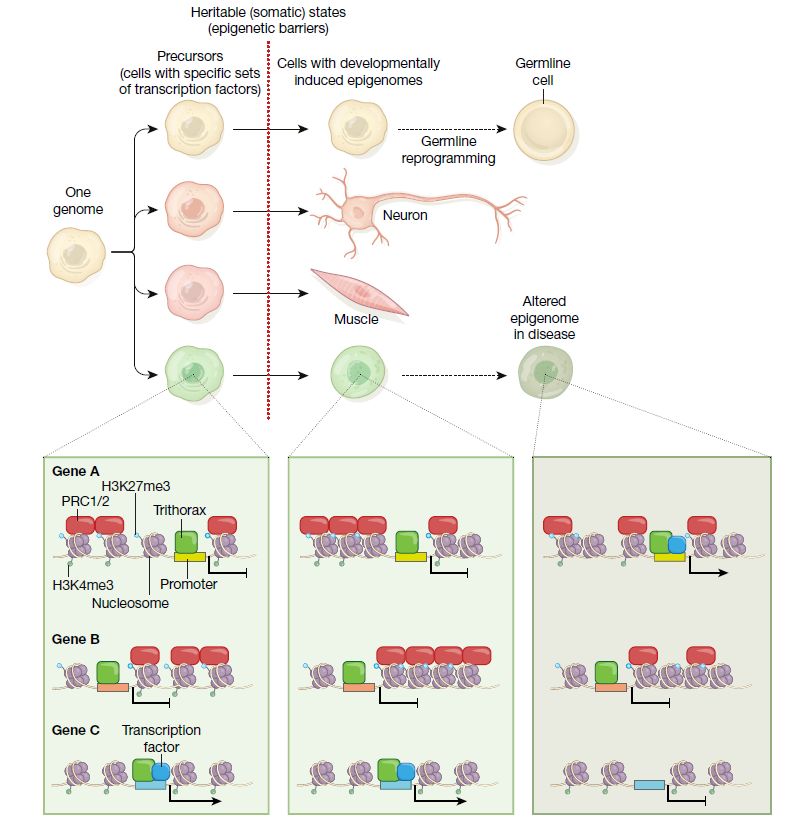
近日,来自法国的Giacomo Cavalli和Edith Heard在Nature杂志上发表综述文章Advances in epigenetics link genetics to the environment and disease,文章对表观遗传学的定义采用“在相同DNA序列条件下,能够持续性改变基因活性状态的分子和机制的研究”。重点探讨以下几个问题:调节可塑性和稳定的表观遗传力之间的相互作用,包括发育、生理刺激、疾病状态下细胞谱系决定和重编程;非编码RNA、DNA甲基化、异染色质、多梳蛋白(Polycomb)、Trithorax蛋白、3D基因组结构如何调控遗传和基因表达,以及研究中发明的最新技术;探讨代际间的表观遗传,特别是哺乳动物;环境对表观遗传的影响,表观遗传改变对基因完整性的影响;表观遗传研究如何惠及人类健康。

表观遗传的继承性与可塑性
对多种模式动物生物过程的研究表明,染色质作为表观遗传信息的载体,在细胞分裂中能够传递基因激活和失活的状态。比如酵母中异染色质的遗传;哺乳动物中X染色体失活和基因组印记;植物的春化作用;果蝇的位置效应斑等。这些研究证明一旦表达模式建立,即使没有原始信号,不同的基因表达状态也可以在细胞分裂的子代细胞中传递。种系和早期胚胎发生、诱导多能干细胞(iPS)、体细胞核转移中的细胞重编程研究显示染色质和DNA甲基化是重要的“表观遗传障碍”,阻止基因表达变化和细胞身份决定。
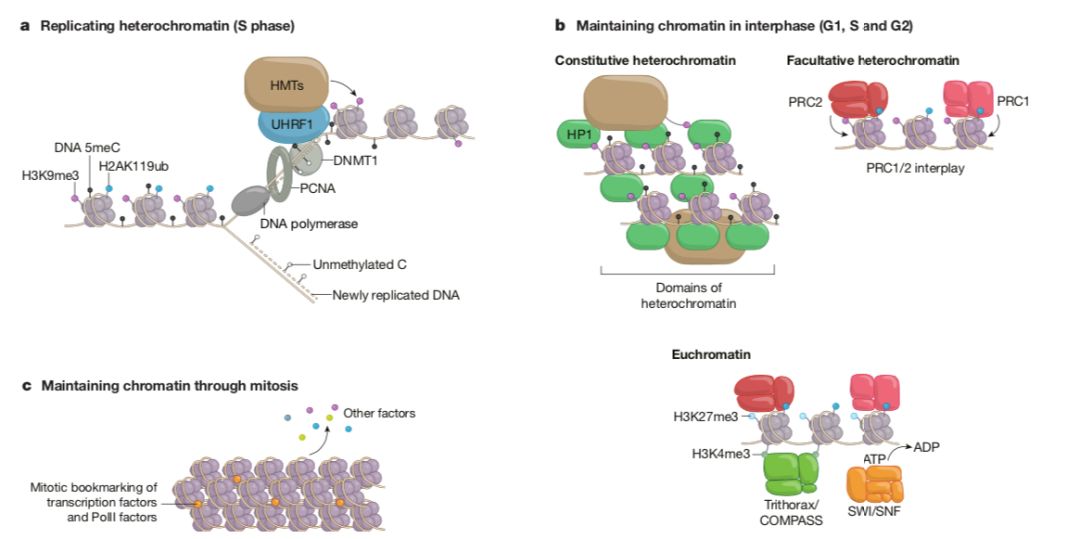
表观遗传系统(epigenetic systems)包括异染色质(HP1)、H3K9me3、多梳蛋白(PRC1、PRC2)和Trithorax(complex proteins associated with SET1,COMPASS)复合物等。通过修饰组蛋白,与各自的组蛋白标志结合保证稳定的遗传。实际上,核小体不断地被重塑,组蛋白可以交换,所有的DNA和组蛋白标志都是可逆的,虽然不同的基因组结构域其交换的速率和标志的稳定性不同。因此,一旦维持染色质状态的自我加强环路消失,大部分的调节性信号都会迅速失去。而且表观遗传标志物需要在细胞分裂过程中经历DNA复制和有丝分裂。核小体的复制并不是一个DNA模版为基础的复制系统,亲本的H3、H4组蛋白位于要复制位点的几百个碱基内,一旦复制,它们需要在特定分子复合物的作用下大致均匀分布到DNA分子的先导链和后随链。即染色质成熟因子,包括DNMT1-UHRF1、EZH2和HP1利用PCNA或ORC作为连接组分;Polycomb利用其DNA锚定因子传递有丝分裂记忆(mitotic memory);有丝分裂中调节性组分包括转录因子和上述表观遗传因子。
有丝分裂和减数分裂中,核小体缺乏精确的“复制过程”,并伴随着很多DNA结合因子和染色体相关组分的丢失,对单个核小体标志物的遗传变得极具挑战。数学建模分析和生物相关证据表明染色质遗传需要建立几百kb的结构域。而基因组是由核小体结合、染色质环、染色体域(拓扑结构域,TADs)、活跃或抑制性间隔和染色体域等一系列的3D结构组成,TADs和间隔能稳定染色质的功能性状态,并驱动子代对其的继承。总之,表观的遗传有多种层次的调控,需要依赖DNA序列,而且需要部分重叠信号的协同。每一层的调控都增加表观遗传的稳定性,但它们均是可逆的,这就给重塑提供可能。对染色质状态的继承依赖于染色质结构域、自我增强机制,需要在DNA复制和有丝分裂中保留转录因子、组蛋白变体和组蛋白修饰。
表观遗传与DNA序列变化
DNA序列变化和表观遗传紧密相关。染色质状态影响转录因子的结合,DNA序列多态性影响染色质状态。染色质和DNA甲基化在人类中间差异很大,而且可以调控基因组的稳定性和可变性。转座子元件是表观沉默的常见靶点,影响基因表达和基因组完整性。
表观遗传的遗传效应
每个个体的基因组都要经历自然的和环境诱导的突变。虽然大多数突变是中性的,但序列的多态性可以影响表观基因组图谱。例如,对来自于不同祖先的父母和孩子的染色质可接近性和CTCF的DNA结合情况进行分析,发现相当多的结合位点具有祖先特异性,即遗传性变异导致不同的结合情况。而CTCF可以影响3D基因组结构和基因表达,那么突变可能导致表观遗传图谱的改变。此外,疾病中常常出现突变影响组蛋白和DNA甲基转移酶、去甲基化酶、染色质重塑蛋白、组蛋白等其他染色质因子的功能,影响表观遗传图谱。
染色质、DNA甲基化和突变
不同条件下,基因组的不同部分的突变速率各异,与细胞来源、环境因素和疾病种类如癌症类型有关。DNA甲基化、核小体位置、高阶染色质折叠都能够影响突变速率。对先天畸形的病人调查的染色质异常进行调查分析,其中7.3%的病人其已知综合征相关基因位点的TADs被破坏;人类癌症中经常检测到CTCF突变,对多发性骨髓瘤进行Hi-C检测,发现CTCF结合的TAD边界的变异断点的拷贝数显著富集。癌症中存在失活X染色体的过度突变,可能由于癌症细胞需要异常过度增殖导致DNA复制压力。
重复基因组的作用
转座子元件(transposableelements,TE)即一段可移动的DNA序列,能够插入到基因组的其他位置。TE是大多数真核细胞基因组的重要组成部分,具有基因调控的潜能,导致表型的多样性。McClintock提出,环境变化或发育过程中,TE可以被“on”或者“off”,可作为“控制元件”。转座子通过作为调控元件或干扰转录过程而影响基因活性。基因组进化出物种特异的机制来限制转座子活性,如利用特定RNA或DNA结合因子靶向抑制性异染色质机器。果蝇中,异染色质依赖的机制促进特定簇的转座子表达,产生PIWI作用RNA(piRNA);反过来,piRNA抑制转座作用。piRNA是亲本遗传的,可以通过ping-pong系统扩增,有效帮助机体抵制新的入侵。线虫利用异染色质组分抑制不合理的重复DNA转录,维持基因组稳定性。植物利用专用聚合酶产生小RNA,靶向DNA甲基化和H3K9甲基化机器。哺乳动物利用多种策略,近期研究较多的是KAP1蛋白(又叫TRIM28)通过与KZFPs蛋白的相互作用,招募异染色质蛋白如SETDB1,抑制内生逆转录病毒(ERVs);同时KZFP和ERVs附近的基因相结合,加快基因调控策略的进化速度,影响基因表达动力学和表达幅度。
环境表观遗传学
基因-环境的相互作用决定了具有相同或不同表型的个体如何对环境变量响应。环境对表观遗传的重要性,特别是Polycomb为基础的植物春化作用,在植物中研究颇多;而类似的过程也存在于一些动物物种。
动物中的环境表观遗传调控
果蝇中,环境诱导的表型依赖于表观遗传调控,可以传递几代;线虫可以将几种环境刺激如病毒感染、饥饿、温度升高等转换成表观遗传组分的修饰。环境影响表观遗传绝不仅仅只在模式研究动物中出现。有一种海龟品种,其性别取决于孵化过程中的温度;KDM6B H3K27me3特异的去甲基酶具有两性、温度依赖性表达的特性,能够调控性别决定基因Dmrt1(Science丨浙江万里学院青年教师破解半个世纪的谜团,揭示乌龟性别决定机理)。一种澳大利亚的蜥蜴,染色质的性别决定被高温所改写,产生了性别反转的雌性后代;温度诱导KDM6B和JARID2产生可变剪切,影响PRC2的招募。
哺乳动物中代谢和表观遗传
DNA和染色质修饰需要使用代谢性产物。如S-腺苷基甲硫氨酸(SAM)是DNA和组蛋白甲基化的甲基供体;叶酸和维生素B6、B12诱导SAM产生;α-酮戊二酸(αKG)对DNA、组蛋白去甲基化是必需的;琥珀酸和延胡索酸抑制DNA、组蛋白去甲基化酶;乙酰-辅酶A是组蛋白乙酰化的乙酰基供体;β-羟丁酸抑制I类组蛋白去乙酰化酶;NAD+/NADH调控III类组蛋白去乙酰化酶。因此,代谢的改变能够引起表观基因组的全局性扰动,如DNA甲基化、Polycomb组分、tRNA片段等,而代谢组分的突变或许代表着潜在的治疗靶点。另一方面,代谢改变调控特定位点,诱导能够在代际间遗传的持久性表观遗传修饰。在小鼠中限制蛋白的摄入诱导DNA甲基化,抑制一部分rDNA基因的表达。总之,诸多的证据表明环境和表观遗传调控相关联。但是评估混杂效应、多因素暴露的影响等与表观遗传变异的因果关系仍然具有挑战,尤其是在人类样本中。而最近的发现——组蛋白去甲基化酶KDM5A、KDM6A可以感知氧浓度,调控H3K4me3、H3K27me3——或许是这个方向研究的第一步。
表观遗传的隔代效应
现代进化理论认为进化主要通过表型的自然选择,最终影响DNA序列。非DNA序列信息如父母、生态、行为和文化信息等可以遗传,这个发现与现代进化理论的框架并不冲突。我们可以推断最终是DNA驱动的父母、生态、行为等信息,DNA序列可以解释遗传的复杂性。
植物和动物中多项证据显示表观遗传的隔代效应,并且可能参与建立早期发育模式。酵母存在着隔代的表观遗传继承(TEI),参与RNAi依赖的异染色质沉积,导致Clr4-依赖的H3K9me3修饰;如果没有RNAi依赖的扩增过程,H3K9me3修饰不足以驱动稳定的表观遗传记忆,除非组蛋白去甲基化酶Epe1突变失活。植物也存在TEI,植物的表观等位基因可以在多代中保持稳定。TEI通常由RNA介导的DNA甲基化维持,染色质组分如组蛋白伴侣分子CAF-1可以调控DNA甲基化依赖的TEI。
与植物不同,大多数有性繁殖的有机体中,生殖系和体细胞分离,信息的流动方向智能是从生殖细胞到体细胞。而且,大多数表观基因组特征在减数分裂过程中被抹去。那么一个重要的问题是,有多少的表观遗传能够在减数分裂过程中保留?线虫的表观等位基因由异染色质组分介导,根据诱导模式不同可能依赖或非依赖piRNA。果蝇中,热激或渗透压应激条件下,异染色质组分诱导TEI;转座子元件活性导致piRNA,pi RNA产生TEI;Polycomb蛋白依赖的机制可以导致TEI。低蛋白饮食导致PRC2酶活性亚基E(z)上调或者抑制PRC2能够导致H3K27me3的变化,并影响寿命,这种影响至少能够传递2代。这些数据表明异染色质和Polycomb可以诱导隔代的表观遗传继承(TEI)。
哺乳动物的隔代遗传
脊椎动物在受精后和发育原始生殖细胞过程中,其DNA甲基化经历两次全局性的削弱,组蛋白标记和3D基因组排列也经历重编程,而且在哺乳动物,尤其是人类中很难排除潜在的混杂因素,如母亲的贡献、精液的成份、子宫的变化及产后影响等。所以哺乳动物中存在隔代的表观遗传吗?一个经典的例子就是,IAP内生逆转录病毒在小鼠皮毛颜色位点的插入取决于遗传的皮毛颜色基因的替代启动子上IAP逆转录病毒的甲基化状态。但最近的调查显示IAP的插入能经历多代遗传的很少。有些报道称饮食或化学暴露和行为应激能够遗传多代,但其中一些结果值得质疑。人群数据调查显示20世纪初祖父母的食物供给和后几代的死亡率有关,但具体分子机制不明。DNA甲基化有可能参与其中,人类原始生殖细胞生成需要经历去甲基化,但参与神经和代谢紊乱的逆转录因子和一些基因仍保持甲基化状态。最近一项研究显示,高脂饮食诱导胰岛素抵抗、肥胖和成瘾性行为可以最多遗传到第三代,但是没有检测出DNA甲基化的遗传性变化。其他的染色质组分也可能参与其中。在精子生成过程中,瞬时过表达H3K4特异的KDM1A组蛋白去甲基化酶导致TEI。这些研究表明TEI在人类中受到限制,但是有存在的可能性。我们需要对TEI的形成机制、DNA序列和表观遗传变化在疾病中的作用等问题进一步研究。
表观遗传、健康和疾病
表观遗传组分的突变如DNA甲基化、组蛋白修饰、非编码RNA等改变在疾病中非常普遍,如果能够区分表观遗传改变是疾病发生的“驾驶员”还是“乘客”角色,那么就能够判定表观遗传对疾病诊断、预后和治疗的影响。研究表观遗传组分和其他疾病间相互作用有利于开发组合干预的方法。
衰老的表观遗传
利用机器学习分析高通量DNA甲基化数据显示,353个基因组位点的CpG甲基化状态与年龄高度相关,所以称为表观遗传时钟(epigenetic clock)。而且,高体质指数加快表观遗传时钟;较高的教育水平、运动状态、低体质指数、健康的饮食能够减缓表观遗传时钟。多数的353CpG位于二价基因(bivalent gene)的平衡启动子或活跃启动子上,表明衰老可能与二价基因表达的可塑性减少相关。近期,综合年龄的临床表型,鉴定出一组能够更好地预测寿命和健康的CpG基因组位点。建立老化过程和CpG甲基化改变之间的联系对确定老化原因至关重要。
发育表观遗传学和疾病
Barker提出假说,在特殊敏感时期如胎儿发育和幼年时期,一些环境因素的暴露如化学因素、药物、应激、感染等可能导致机体在成年期得病。后续的工作表明表观遗传组分可能参与其中,表观遗传组的长期改变影响癌症、肥胖、糖尿病、神经疾病、以及年龄相关的疾病如帕金森、阿尔兹海默症等疾病的易感性。胚胎发育和幼儿期是两个重要的窗口期,此时的表观遗传编程对环境因素如饮食、温度、环境毒素、母亲的行为、童年的虐待等都很敏感。而青春期是行为分子表观遗传的重要窗口期,不良生活经历影响焦虑、抑郁和攻击性行为的风险,可能与特定基因的DNA甲基化或HDAC1水平变化有关。而且,记忆的形成与环境刺激相关,与特定位点上组蛋白和DNA的修饰相关。未来的研究应该要确定这些变化是否存在因果关系。
癌症的表观遗传学
在多种癌症中,编码表观遗传组分的基因发生突变,包括DNA甲基化酶、去甲基化酶、组蛋白、组蛋白修饰、参与染色质重塑和染色体结构的基因等,同时代谢性基因如IDH1、IDH2能够影响组蛋白和DNA甲基化,进而影响3D基因组结构,在癌症中也常常发生突变。重复的DNA元件也参与癌症的发生。例如,在霍奇金淋巴瘤中,IRF5的转录是由位于启动子上游的一个正常休眠的内生性逆转录冰露长末端重复序列的DNA地甲基化诱导,驱动肿瘤的发展。虽然表观遗传的变动常常伴随着肿瘤驱动基因的突变,但在小鼠中出现没有驱动基因的DNA突变也可以诱导肿瘤产生的案例。而且,对胰腺癌转移的分析没有发现任何明显的驱动突变;相反,观察到大规模的染色质重编程,许多染色体区域的H3K9me3水平发生改变。这些发现表明表观遗传的改变在特定情景下能够是癌症进程的主要驱动者。
总结
20世纪下半叶的重大发现是人们对于DNA在进化、生物学、医学中的作用的认知,从而将DNA视为“生命之书”。但“DNA不是你的宿命”,因为相同的DNA对应着不同的遗传表型,这就是表观遗传学的力量。表型是由基因组组成、表观遗传组分、环境输入三者间的结合而造就。对表观遗传的研究可以推动着个人化的精准药物的研发,可以阐述生活习惯和“心-身”干扰对健康的作用,这些表观遗传的深入研究必将深化我们的知识,惠及人类的健康。
原文链接:
https://doi.org/10.1038/s41586-019-1411-0
来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652478361&idx=1&sn=c4922e8f1c421b5fcc96f07f69958da8&chksm=84e2082db395813bdb2ecd9b615192c0419beb4831f0c70b304a48fe1b918044f09f9adadf1e#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



