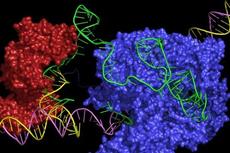
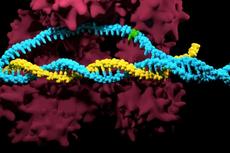
Tn7样转座子已采用CRISPR系统,包括1类I-F,I-B和2类V-K。有趣的是,尽管这些与CRISPR相关的转座酶(CAST)经历了强大的CRISPR RNA(crRNA)引导的转座,但它们几乎从未在同源CRISPR阵列编码的crRNA靶向的位点中发现。
2021年3月25日,博德研究所张锋团队在Cell 在线发表题为“Dual modes of CRISPR-associated transposon homing”的研究论文,该研究发现了CAST V-K和I-B两种系统不同的转座模式:(1)crRNA引导的转座和(2)CRISPR阵列独立的归巢。
该研究显示了不同的CAST系统利用不同的分子机制来靶向其归巢位点。V-K型CAST系统使用短的,离域的crRNA进行RNA引导的归巢,而I-B CAST型系统包含两个不同的靶选择蛋白,使用TniQ进行RNA引导的DNA转座,并使用TnsD进行归巢到附着位点。这些发现阐明了CAST系统生命周期中的关键步骤,并突出了介导转座子归巢的分子机制的多样性。
另外,2020年11月27日,博德研究所的Paola Arlotta、张锋、Aviv Regev及Xin Jin等在Science 在线发表题为“In vivo Perturb-Seq reveals neuronal and glial abnormalities associated with autism risk genes” 的研究论文,该研究应用了一种可扩展的遗传筛选方法,体内Perturb-Seq,功能上评估了35个自闭症谱系障碍/神经发育延迟(ASD / ND)从头开始丧失功能的风险基因。 使用CRISPR-Cas9,该研究在子宫内发育中的小鼠大脑内的库中的这些风险基因中引入了移码突变,然后对产后大脑中受干扰的细胞进行单细胞RNA测序。该研究从神经元和神经胶质细胞分类中鉴定了细胞类型特异性和进化保守的基因模块。总之,体内Perturb-Seq可以用作大型基因组的系统遗传研究的可扩展工具,以揭示其在复杂组织中单细胞分辨率下的细胞内在功能(点击阅读)。
2020年9月16日,张锋团队在新英格兰医学期刊(NEJM)发表题为:Detection of SARS-CoV-2 with SHERLOCK One-Pot Testing 的文章,张锋团队公布了升级版基于SHERLOCK技术的新冠病毒检测流程——STOPCovid.V2。升级版的STOPCovid.V2在原有基础上更进一步,在样本制备的过程中通过加入磁珠富集样本中的RNA,从而通过提高PCR反应的起始RNA数量,进一步提高了STOPCovid.V2的检测灵敏度。此外,2.0版还精简了磁珠富集RNA的操作步骤,去除了乙醇清洗和洗脱过程,让整个RNA富集过程不超过15分钟。最后,研究团队进行了一项双盲检测,对202个新冠病毒阳性和200个新冠病毒阴性鼻咽拭子样本的检测结果表明,STOPCovid.V2能够达到93.1%的灵敏度和98.5%的特异性。且阳性样本只需15-45分钟就能获得结果(点击阅读)。
2020年8月28日,博德研究所张锋团队在Science 在线发表题为“Diverse enzymatic activities mediate antiviral immunity in prokaryotes”的研究论文,该研究通过系统的防御基因预测和异源重组,发现29种广泛的抗病毒基因盒,共同存在于32%的所有已测序细菌和古细菌基因组中,它们介导了针对特定噬菌体的保护。这些系统结合了以前没有参与抗病毒防御的酶促活性,包括RNA编辑和卫星DNA合成逆转录。 此外,该研究在计算上预测了仍有待鉴定的各种其他推定防御基因。这些结果突出了微生物对病毒使用的大量分子功能。该研究对于理解自然微生物种群中的抗病毒抗性和宿主病毒相互作用以及技术应用(例如开发抗菌治疗剂,核酸编辑,分子检测和靶向细胞破坏)具有广泛的意义(点击阅读)。
2020年3月17日,博德研究所张锋团队在Molecular Cell 在线发表题为“Highly Parallel Profiling of Cas9 Variant Specificity”的研究论文,该研究该研究描述了基于标签的标签整合位点测序(TTISS)方法,这是一种有效的,可扩展的分析双链断裂(DSB)的方法。该研究将其并行应用于跨59个靶标的8个Cas9变体。此外,该研究生成了成千上万个其他Cas9变体,并筛选了具有增强的特异性和活性的变体,从而确定了LZ3 Cas9,这是一种具有唯一+1插入模式的高特异性变体。总之,这项全面的比较揭示了Cas9活性和特异性之间的一般权衡,并提供了有关+1插入产生频率的信息,这对纠正移码突变具有影响(点击阅读)。

CRISPR-Cas系统是原核生物用于防御外来遗传成分的适应性免疫系统。CRISPR-Cas成分除了具有适应性免疫功能外,还具有多种作用,但是包括通过转座子共同选择灭活的Cas效应器机制而导致的引导转座。
迄今为止,已通过实验表征了CRISPR相关转座子(CAST)系统的两个不同亚型,这些亚型可促进Tn7样转座子的RNA引导靶向:VK CAST系统,该系统利用具有天然失活的核酸酶结构域的Cas12k效应子;IF CAST系统,该系统利用了缺少Cas3核酸酶成分的Cascade复合物。此外,已经通过生物信息学鉴定了IB型CAST系统,该系统还包含Cascade效应子与Tn7样转座子相关的成分,但与其他CAST系统相比极为罕见,但尚未进行实验表征。
来自大肠杆菌的原型Tn7转座子使用核心转座酶蛋白TnsA,TnsB和TnsC介导转座。这些转座酶蛋白以两种模式运行:(1)归巢,其中TnsABC与位点特异性DNA结合蛋白TnsD相互作用,以实现转座到染色体glmS附着位点(也称为归巢位点);(2) TnsABC与TnsE相互作用的一种蛋白质,该蛋白质可优先将转座子引导至包括共轭质粒的移动元件。这两种途径使转座子可以安全有效地从一个宿主传播到另一宿主:通过移动元件后,TnsD途径靶向跨宿主保守的位点以安全地回到细菌染色体。缺乏tnsE的CAST系统依靠其CRISPR阵列中的间隔子实现靶向转座,可能移动遗传元件。
然而,细菌染色体中大多数已鉴定的CAST系统并非位于其CRISPR阵列所编程的靶标上,而是位于保守序列的旁边,在IF型的情况下包括IMPDH和SRP RNA,表明CAST系统可能具有先天的归巢位置。迄今为止发现的所有已知CAST系统都包含tniQ(tnsD的同系物)。
在这里,该研究探索了CAST系统如何特异地转座到细菌染色体上,并分别识别涉及RNA介导的和蛋白质介导的归巢的V-K型和I-B型系统的两种不同的归巢模式。该研究显示了不同的CAST系统利用不同的分子机制来靶向其归巢位点。 V-K型CAST系统使用短的,离域的crRNA进行RNA引导的归巢,而I-B CAST型系统包含两个不同的靶选择蛋白,使用TniQ进行RNA引导的DNA转座,并使用TnsD进行归巢到附着位点。这些发现阐明了CAST系统生命周期中的关键步骤,并突出了介导转座子归巢的分子机制的多样性。
参考消息:
https://doi.org/10.1016/j.cell.2021.03.006
来源:iNature
原文链接:http://mp.weixin.qq.com/s?__biz=MzU3MTE3MjUyOA==&mid=2247523670&idx=3&sn=078c8df9934a33e570c7396773d60c14
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn