来源:BioArt
原标题:Cell Reports:谢适其博士等利用单细胞CRISPR筛选技术揭示细胞内增强子驱动的调控网络
增强子 (Enhancer)是位于基因组上的非编码调控元件,可以通过促进启动子 (Promoter)的活性来调控基因的表达。继人类基因组计划以来,许多大型联合科研项目,例如ENCODE,Roadmap Epigenomics Project等,已经鉴定出人类基因组上的超过1百万可能的增强子区域,远远大于基因的数量。这些增强子具有高度的细胞特异性 (Cell Type Specificity) ;更重要的是,大量人类疾病和性状相关的SNP (GWAS-associated SNPs) 都位于增强子或其相临的区域。这些研究成果显示出增强子对于人类疾病发生机理以及组织发育都具有重要作用。然而,我们对大部分增强子功能还知之甚少。
为了研究增强子的功能,我们首先需要准确鉴定其所调控的基因。然而在人类基因组中,增强子与其目标基因之间通常有一定的距离(可上至1百万碱基)。这一特性使得我们难以直观地确定每一个增强子的直接目标基因 (Primary Targets) ;更复杂的是,如果一个增强子的直接目标基因为转录因子 (Transcriptional Factor) ,这个增强子就能够通过这些转录因子,间接地调控基因组上其他位置的基因(Secondary Targets,间接目标基因) 。
在2017年的Molecular Cell杂志上, 来自美国德州大学西南医学中心(UT Southwestern Medical Center) 的Gary Hon教授团队报导了一项技术Mosaic-seq,为如何高通量测定细胞内源的增强子活性测定提供了新的思路【1】。该技术结合CRISPRi和单细胞RNA测序(Single-cell RNA-seq), 能够在同一个细胞中同时获取两种关键信息:1)哪些增强子被抑制;2)这些增强子的抑制产生了怎样的表型(转录组信息)。然而,由于种种限制,该方法在统计学检验时有大量的假阳性结果。为了保证结果的可信度,只能缩小分析范围为增强子的临近基因,使得类似技术只能测定增强子的直接目标基因【1,2】。
2019年11月26日,Gary Hon教授团队再一次在Cell Reports杂志上发表题为 Global Analysis of Enhancer Targets Reveals Convergent Enhancer-driven Regulatory Modules 的文章,进一步优化了这一技术,提高了实验灵明度和准确性,从而实现了同时对增强子直接和间接目标基因的检测。

该研究从计算和实验两方面优化了Mosaic-seq技术:
1)作者发现,在差异性基因分析中,通过进行基因特异性的p值矫正能够显著地去除分析中的假阳性结果但保留真正目标基因。
2)作者发现增加gRNA的数量可以有效降低假阳性基因的数量。之前的研究仅仅针对每个增强子区域设计了2-3条gRNA,因此容易受到CRISPR系统中单个gRNA脱靶效应的影响。在本工作中,作者大幅增加了gRNA的数量到每个增强子10条gRNA,从而能够稀释脱靶gRNA的影响。同时,通过数据模拟,作者证实当脱靶gRNA对统计检验的贡献超过1/3时,脱靶基因会被鉴定为真实目标基因。由于不同的gRNA的脱靶目标通常不相同,作者因此建议后续的研究至少应针对每个靶点设计4条gRNA,使得单个gRNA的贡献不超过三分之一。
利用改进过后的技术,作者研究了K562细胞中的约500个增强子的功能,同时鉴定了他们的直接和间接目标基因。根据这些结果,作者建立了增强子驱动的转录调控网络(Enhancer-driven Regulatory Network, ERN),将增强子,其直接和间接目标基因都联系起来。有趣的是,虽然作者并没有刻意根据已知功能挑选目标增强子区域,许多位于基因组不同位置的增强子却拥有共同的间接目标基因,这其中包括人类血红蛋白家族等在该细胞中被多种转录机制精确调节的基因。这些结果提示疾病中的关键基因实际可能被位于染色体完全不同位置的增强子所调控。
最后,作者展示了如何利用ERN来解释人类疾病/性状相关SNP的作用机制。上述实验中分析了四个位于MYB基因下游140kb的增强子。这些增强子附近有很多的血液相关GWAS SNP。由于位于AHI1基因内部,这些SNP在关联性分析中常被认为会通过调控AHI1基因造成血液相关疾病。根据本文实验数据,作者指出这一系列的增强子的直接目标基因是MYB。更重要的是,在所有的血液细胞中,其中一个增强子只存在于造血干细胞中,其DNA序列在所有脊椎动物中也高度保守。由于MYB基因的下调是红细胞生成 (Erythropoiesis) 重要调控机制,这些证据提示该增强子以及相关的SNP对MYB基因的调控很可能在造血干细胞的分化过程中发挥了重要的作用。
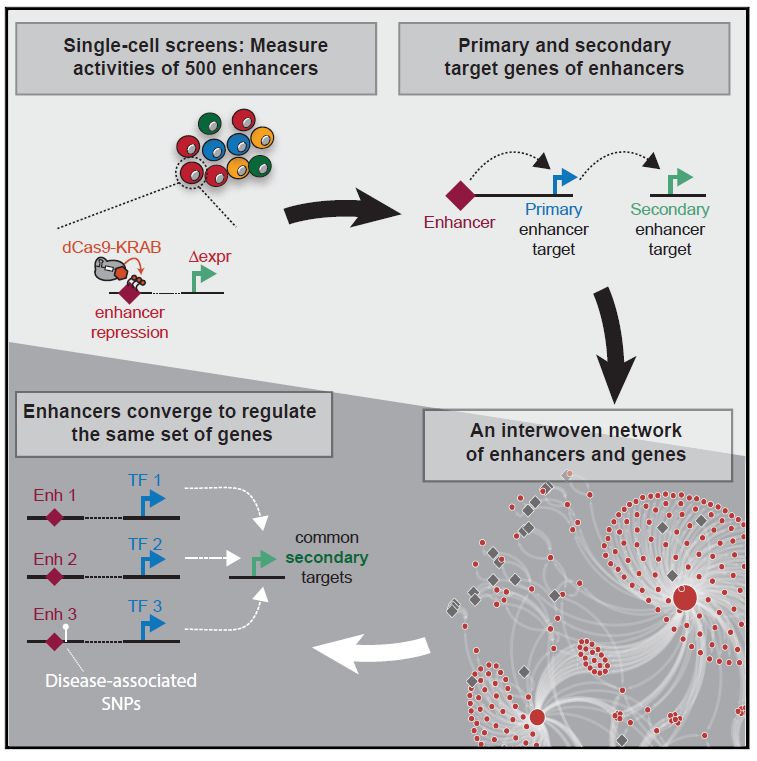
综上所述,该研究通过对Mosaic-seq技术的优化,向我们揭示了不同的增强子如何通过复杂的调控网络影响相同基因的表达。这项技术可以大规模应用于不同组织中的增强子,这有助于进一步揭示位于基因组非编码区域的突变是如何对人类疾病和发育造成影响的分子生物学机制。
据悉,本文的第一作者为谢适其博士,通讯作者为Gary Hon教授。
原文链接:
https://doi.org/10.1016/j.celrep.2019.10.073
参考文献
1.Xie, S., Duan, J., Li, B., Zhou, P. & Hon, G. C. Multiplexed Engineering and Analysis of Combinatorial Enhancer Activity in Single Cells. Mol. Cell 66, 285–299.e5 (2017).
2.Gasperini, M. et al. A Genome-wide Framework for Mapping Gene Regulation via Cellular Genetic Screens. Cell 176, 377–390.e19 (2019).
来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652478248&idx=6&sn=76de4af7fa0bc9698bd0b5ed0e066a3f&chksm=84e2089cb395818a2d91c801150398b1578cc6b2d3359dea74f5dd533d92d374fba5fc8b6ce4#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn


