来源:植物科学最前沿
2021年3月7日,著名学术期刊 Molecular Plant 在线发表了南京农业大学生命科学学院谢彦杰课题组题为"Hydrogen Sulfide-linked Persulfidation of ABSCISIC INSENSITIVE 4 Controls Arabidopsis ABA Responses Through the Transactivation of Mitogen-Activated Protein Kinase Kinase Kinase 18 "的研究论文。该论文揭示了硫化氢和硫巯基化修饰通过反式激活MAPK信号通路从而调控脱落酸(ABA)途径。

研究背景
气孔关闭是植物应对干旱胁迫的一种快速响应策略。气孔作为植物与环境之间气体和水分交换的门户,其调节机理的研究,对于干旱地区的作物生产来说极具指导意义。植物激素脱落酸(ABA)在植物应对不利环境条件的适应过程中起着重要作用,其中一个重要的作用就是调节气孔运动。然而ABA对气孔的精准调节通路仍有很多细节需要发掘。
硫化氢(H2S)是植物-环境相互作用中的重要信号分子。L-半胱氨酸脱硫酶1(L-CYSTEINE DESULFHYDRASE 1,DES1)是拟南芥细胞质中产生H2S的重要酶。H2S介导的信号激活与传递通过硫巯基化修饰来介导,即蛋白质Cys残基上的R-SH转变为R-SSH。植物激素ABA在植物应对不利环境条件的适应过程中起着重要作用,ABA能诱导保卫细胞中DES1的硫巯基化修饰和H2S的产生,从而促进气孔关闭。然而,H2S和硫巯基化修饰如何参与传递ABA信号的分子机制还有有待阐明。
主要研究结果
1)在之前的研究中,谢彦杰课题组已经报道了内源H2S合成酶L-半胱氨酸脱硫酶1(L-CYSTEINE DESULFHYDRASE 1, DES1)和ABI4都参与ABA介导的气孔关闭。进一步的转录分析发现,des1突变体中ABI4受ABA诱导的表达量下降。同时双突和回补实验也表明ABI4在DES1下游起作用。
2)H2S具有很高的膜透性,作者推测ABI4通过可以被H2S过硫化。利用tag-switch assay,作者验证了ABI4在体外和体内都可以被过硫化(图1A-C)。有三个半胱氨酸残基可能是过硫化的位点,作者通过点突变,证明了ABI4第250位的半胱氨酸残基被过硫化(图1D-G)。
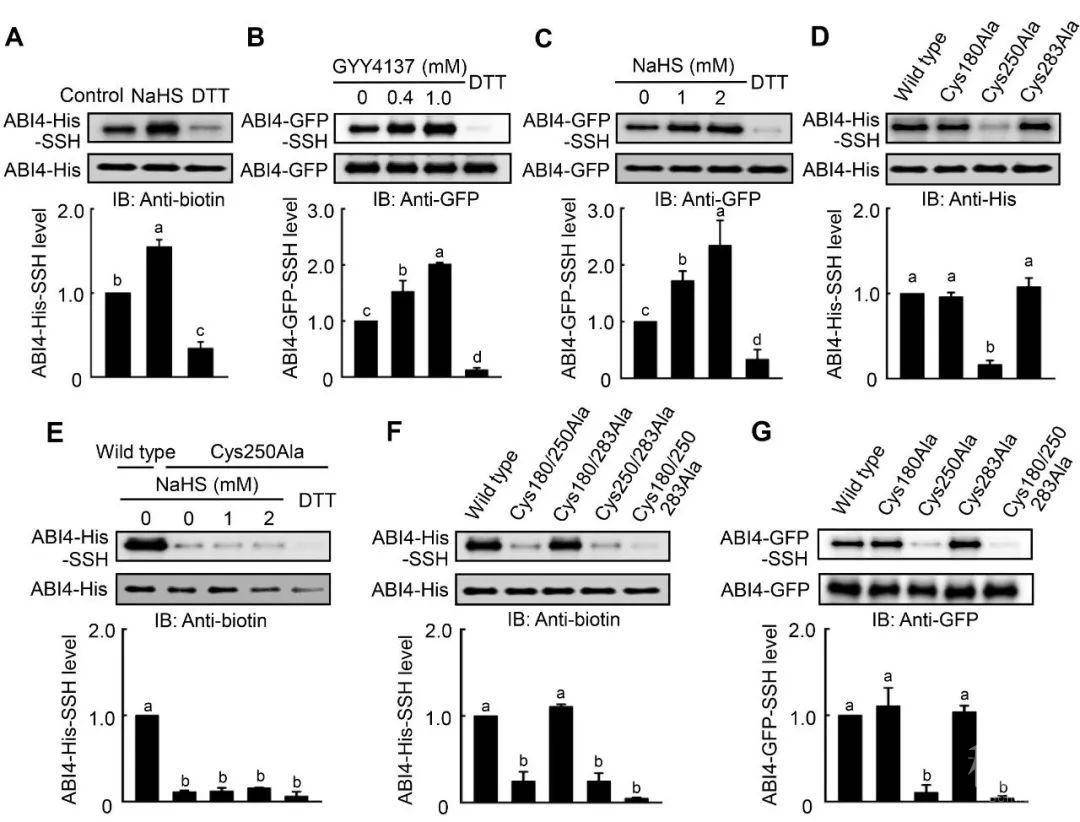
图1. ABI4在第250位半胱氨酸残基处被过硫化
3)通过点突变,作者验证了ABI4第250位的半胱氨酸残基的过硫化对ABI4的功能非常重要。同时,通过遗传学实验,作者发现DES1合成的H2S对ABI4的功能很重要。
4)有报道表明ABI4的活性受MAPK级联调控。因此作者探究了是否有MAPK响应ABA,并发现MAPKKK18受ABA诱导并在保卫细胞中高表达(图2A)。进一步研究发现,MAPKKK18的启动子含有ABI4的结合区域(图2B-D),且ABI4第250位的半胱氨酸残基的过硫化可以调控ABI4对MAPKKK18的启动子的结合(图2E,F)。
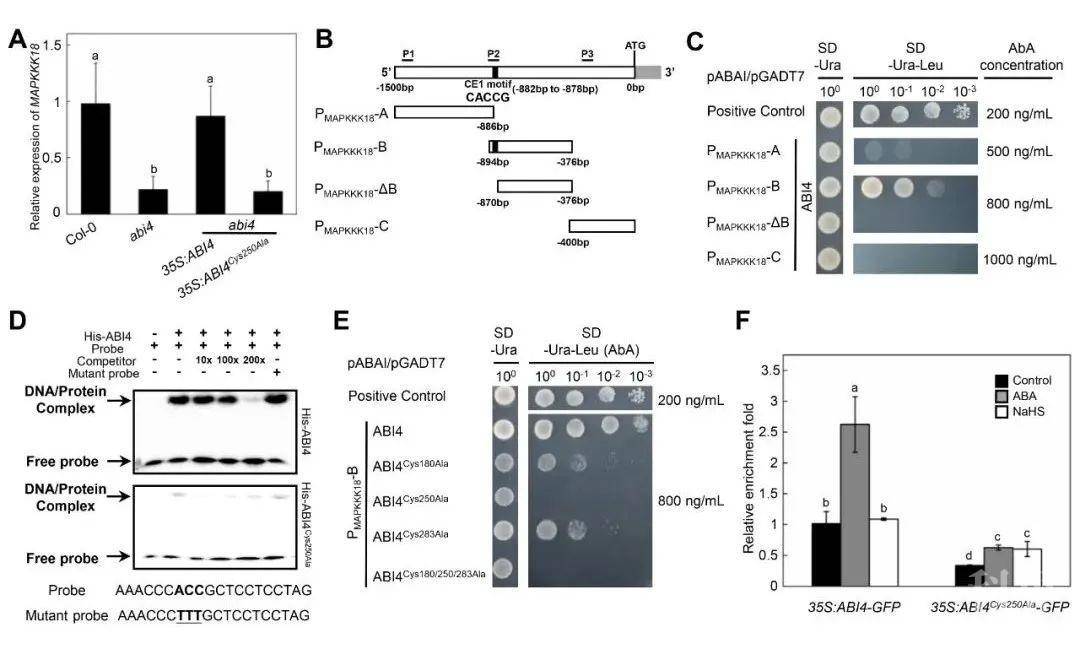
图2. ABI4第250位的半胱氨酸残基的过硫化调控ABI4对MAPKKK18启动子的结合
一图解文
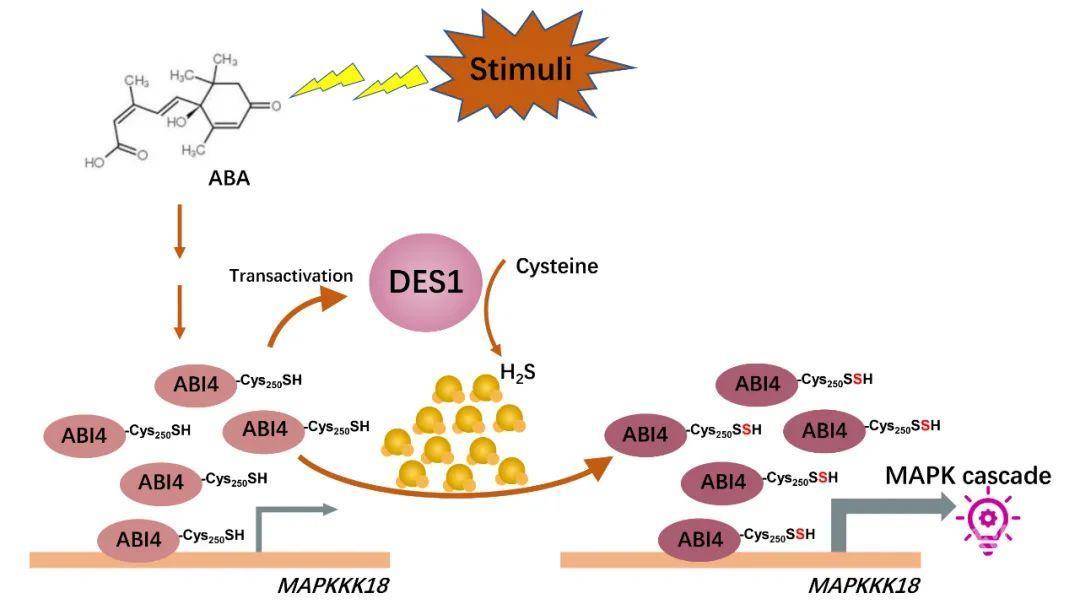
图3. DES1, ABI1和MAPKKK18协同调控ABA途径的示意图
研究意义
该项研究结果揭示了ABI4是ABA信号与MAPK级联系统信号传递的交汇枢纽,同时阐明了H2S介导的巯基化修饰在ABA转录调控中功能。在ABA信号中,H2S引发ABI4 Cys250发生硫巯基化修饰,进一步促进了MAPKKK18的转录激活。相关研究结果拓展了我们对H2S和硫巯基化修饰在ABA信号转导转录水平调控的认识,也为植物干旱胁迫应答领域的研究展示了一个新的视角,在作物抗逆育种和抗逆调剂剂开发等方面有非常重要的应用前景。
作者介绍
该研究以南京农业大学生命科学学院为第一单位。南京农业大学生命科学学院博士生周明健、张晶、已毕业硕士沈杰和师资博士后周恒为该论文的同等贡献第一作者,谢彦杰教授为通讯作者。国家蛋白质科学中心杨靖研究员、西班牙国家科学研究委员会Cecilia Gotor和Luis Romero研究员、南京农业大学沈文飚教授、江苏省农科院经作所袁星星副研究员参与了部分研究工作。该研究得到了国家自然科学基金、江苏省自然科学基金、中国博士后科学基金和欧洲区域发展基金资助。
裴雁曦(山西大学,教授)
气孔关闭是植物应对干旱胁迫的一种快速响应策略。气孔作为植物与环境之间气体和水分交换的门户,其调节机理的研究,对于干旱地区的作物生产来说极具指导意义。植物激素脱落酸(ABA)在植物应对不利环境条件的适应过程中起着重要作用,其中一个重要的作用就是调节气孔运动。然而ABA对气孔的精准调节通路仍有很多细节需要发掘。
硫化氢(H2S)是一种近年来获得广泛关注的气体信号分子,H2S以其“无处不在”的特点,在动物和植物体内广泛参与了各个系统的功能调节。已经证实H2S实现信号分子功能的重要方式是对目标蛋白Cys残基进行硫巯基化修饰(-SSH),影响其构象和活性。植物体内的H2S生理功能研究起步较晚,但是发展迅速。随着世界上多个课题组对H2S调节植物气孔运动的报道,这一信号分子迅速成为备受关注的气孔调控信号组分。但是其调控机理一直知之甚少。南京农业大学生命科学学院谢彦杰教授课题组近年来的研究成果无疑是这个研究领域熠熠的亮点。该课题组2020年发表于Plant Cell和PlantCell & Environment的研究论文显示,ABA能诱导保卫细胞中重要内源H2S生成酶DES1的硫巯基化修饰和H2S的产生,从而促进气孔关闭。但H2S如何继续传递ABA信号仍然是一个有待阐明的重要科学问题。
2021年3月7日, Molecular Plant在线发表了谢彦杰教授课题组在H2S信号转导领域的最新研究论文,题为HydrogenSulfide-linked Persulfidation of ABSCISIC INSENSITIVE 4 Controls ArabidopsisABA Responses Through the Transactivation of Mitogen-Activated Protein Kinase KinaseKinase 18。该研究发现H2S可以介导ABA信号途径中正调控因子ABA INSENSITIVE4(ABI4)的Cys250硫巯基化修饰,这种翻译后修饰提高了ABI4下游靶标MAPKKK18的转录激活,H2S信号通过这个ABI4-MAPKKK18通路调控了植物的ABA应答反应。该文鉴定出H2S信号分子作用的新靶点ABI4;也揭示了H2S通过硫巯基化修饰ABI4调控ABA信号的新通路。这不但是气体信号分子H2S领域的重要进展,也为植物干旱胁迫应答领域的研究展示了一个新的视角,在作物抗逆育种和抗逆调剂剂开发等方面有非常重要的应用前景。
王鹏程 (上海植物逆境中心,研究员)
氧化还原是生命最本质的化学过程之一。一些具有氧化还原活性的小分子可以作为信号分子参与各种生命过程的调控。比如,H2O2、NO、H2S等活性小分子作为第二信使参与了ABA信号途径。H2O2诱导保卫细胞中Ca2+的产生,是保卫细胞ABA信号途径的核心组分(Pei et al., 2020, Zhang et al., 2001)。H2O2还通过调控蛋白磷酸酶ABI1/2的活性直接参与ABA受体偶联的途径(Hua et al., 2012; Miao et la., 2006; Murata et al., 2001)。ABA诱导NO产生,NO通过发生在半胱氨酸(Cys)残基的巯基亚硝酰化(S-nitrosylation)抑制OST1的活性、促进ABI5蛋白的降解(Wang et al., 2015; Albertos et al., 2015)。NO还可以通过发生在ABA受体PYL蛋白的酪氨酸硝化(tyrosine nitration)抑制ABA信号途径,介导ABA受体偶联途径的失活(desensitization)。
与NO不同,近年来的一些证据显示H2S可能通过Cys残基的过硫化(Persulfidation)正向调控ABA信号途径。2020年,南京农业大学谢彦杰课题组在Plant Cell杂志发表文章,发现ABA通过氧化还原方式调控内源H2S合成酶L-半胱氨酸脱硫酶1(L-CYSTEINE DESULFHYDRASE 1, DES1)的活性,继而通过对植物活性氧产生关键酶NADPH氧化酶D(RBOHD)的过硫化(Persulfidation),增强其产生活性氧的能力(Shen et al., 2020)。这一工作显示H2S在ABA诱导的活性氧产生过程中的关键作用。今天,Molecular Plant杂志在线发表了谢彦杰课题组另一工作,发现ABA信号途径的转录因子ABI4也可以发生过硫化。ABI4蛋白250位半胱氨酸的过硫化对于其介导MAPKKK18的转录过程是必需的。这一研究揭示了过硫化修饰在ABA介导的转录调控过程的新机制,揭示除了磷酸化、SUMOylation、S-nitrosylation之外,ABA还通过氧化还原修饰直接调控转录因子的活性,介导基因表达过程。
值得注意的是,同一蛋白的特定半胱氨酸残基可以发生不同的氧化还原修饰,而不同的氧化还原修饰对蛋白活性的调控可能是不同的。例如,RBOHD蛋白Cys890的S-nitrosylation抑制RBOHD的活性(Yun et la., 2011),而同一位点的Cys890的Persulfidation则促进RBOHD的活性(Shen et al., 2020)。在体内,这些不同氧化还原修饰是如何决定的,以及同一位点的不同的修饰如何戏剧性地逆转靶蛋白功能,是一个非常有趣的科学问题,值得深入研究。
参考文献:
Albertos P, Romero-Puertas MC, Tatematsu K,Mateos I, Sánchez-Vicente I, Nambara E, Lorenzo O (2015) S-nitrosylationtriggers ABI5 degradation to promote seed germination and seedling growth. Nat.Commun. 6: 8669
Hua D, Wang C, He J, Liao H, Duan Y, Zhu Z,Guo Y, Chen Z, Gong Z (2012) A plasma membrane receptor kinase, GHR1, mediatesabscisic acid- and hydrogen peroxide-regulated stomatal movement inArabidopsis. Plant Cell 24: 2546-2561
Miao Y, Lv D, Wang P, Wang XC, Chen J, MiaoC, Song CP (2006) An Arabidopsis Glutathione Peroxidase Functions as Both aRedox Transducer and a Scavenger in Abscisic Acid and Drought Stress Responses.Plant Cell 18: 2749-2766
Murata Y, Pei ZM, Mori IC, Schroeder J(2001) Abscisic acid activation of plasma membrane Ca2+ channels in guard cellsrequires cytosolic NAD(P)H and is differentially disrupted upstream anddownstream of reactive oxygen species production in abi1-1 and abi2-1 proteinphosphatase 2C mutants. Plant Cell 13: 2513-2523
Pei Z-M, Murata Y, Benning G, Thomine S,Klusener B, Allen GJ, Grill E, Schroeder JI (2000) Calcium channels activatedby hydrogen peroxide mediate abscisic acid signalling in guard cells. Nature406: 731-734
Shen J, Zhang J, Zhou M, Zhou H, Cui B,Gotor C, Romero LC, Fu L, Yang J, Foyer CH, Pan Q, Sheng W, Xie Y (2020)Persulfidation-based modification of cysteine desulfhydrase and the NADPHoxidase RBOHD controls guard cell abscisic acid signaling. Plant Cell32: 1000-1017
Wang P, Du Y, Hou Y-J, Zhao Y, Hsu C-C,Yuan F, Zhu X, Tao WA, Song CP, Zhu JK (2015) Nitric oxide negatively regulatesabscisic acid signaling in guard cells by S-nitrosylation of OST1. Proc.Natl. Acad. Sci. USA 112: 613-618
Yun B-W, Feechan A, Yin M, Saidi NBB, LeBihan T, Yu M, Moore JW, Kang J-G, Kwon E, Spoel SH et al (2011)S-nitrosylation of NADPH oxidase regulates cell death in plant immunity. Nature 478: 264-268
Zhang X, Zhang L, Dong F, Gao J, GalbraithDW, Song CP (2001) Hydrogen Peroxide Is Involved in Abscisic Acid-InducedStomatal Closure in Vicia faba. Plant Physiol. 126:1438-1448
原文链接:http://mp.weixin.qq.com/s?__biz=MzIyOTY2NDYyNQ==&mid=2247509782&idx=3&sn=173a260c6de6d5c2c476f9a7eb9e0fe9
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



