来源:昆虫科学
昆虫生活在极其复杂的环境中。其肠道上皮无时无刻不与微生物接触,这些微生物群落种类繁多,数量庞大,它们在肠道中形成一个相对稳定的微生物生态系统,影响宿主生理功能的不同方面。因此,维持肠道微生物群落的稳态在昆虫的生长、发育和繁殖过程中具有特别重要的意义。
华中农业大学张宏宇教授团队长期从事昆虫微生物组学研究。在研究阐述实蝇肠道和生殖系统微生物多样性、群落组成(Wang et al., 2011a, J Appl Microbiol; Wang et al., 2011b, Phytopathol; Shi et al., 2012, Int J Mol Sci),发现肠道益生菌影响宿主橘小实蝇生态行为(Wang et al., 2014, Pest Manag Sci)、修复宿主橘小实蝇的辐射源生态适应力损伤(Cai et al., 2018, Evol Appl)和提高宿主抗寒能力(Raza et al., 2020, PLoS Pathogens)等生理功能,以及发现实蝇BdDuox-ROS对宿主肠道微生物群落稳态调控机制(Yao et al., 2016, The ISME J)基础上,系统完整综述了宿主昆虫肠道物理防御、Duox-ROS、Imd、JAK/STAT信号通路以及肠道共生菌群在昆虫肠道微生物群稳态维持中的作用。
研究表明宿主昆虫围食膜(PM)可以防止细菌直接接触肠上皮,是免疫防御的第一道防线。另外,PM还限制了细菌毒素、食物颗粒和中肠上皮之间的接触。这有效地减少了其对免疫系统的过度激活。此外,贲门也能有效防止某些细菌进入中、后肠,从而促进宿主对昆虫病原细菌的防御。
昆虫肠道Imd信号通路在革兰氏阴性细菌感染中介导抗菌肽(AMPs)基因的表达,防御外来入侵微生物、保持肠道微生物稳定和功能。Imd信号通路有两种模式识别受体:跨膜蛋白受体PGRP-LC和细胞质受体PGRP-LE(图1)。Imd信号通路识别细菌释放的DAP型肽聚糖(PGN),从而激活下游转录因子并介导AMPs基因的表达(图1)。研究发现,当果蝇的Imd通路缺失时,宿主更容易受到致病菌的感染。研究表明,长期、慢性激活Imd通路可导致AMPs过表达,导致昆虫肠道微生物稳态失衡。另外,PGRP蛋白家族,Caudal基因(图1)等,可以避免Imd通路过度激活,保护共生细菌,从而在维持肠道共生细菌的稳态中发挥重要作用。
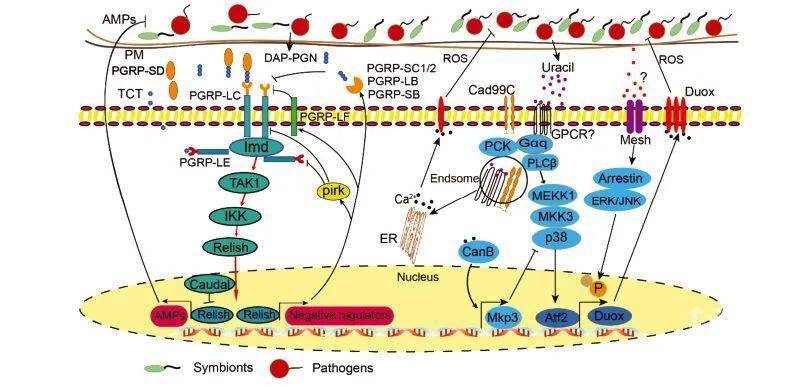
图1. 昆虫肠道Imd和Duox信号通路介导的AMPs和ROS对肠道微生物的调控模式
Duox是NADPH氧化酶家族的一员,在各种刺激下负责产生活性氧(ROS),Duox-ROS信号通路在昆虫肠道微生物稳态调控中起重要作用。研究表明,昆虫肠道中ROS的产生主要受两条信号通路的调控:一是“Duox活性通路”,二是“Duox表达通路” (图1)。激活这两种途径对于大量产生杀微生物ROS是必要的。研究表明,宿主能够识别致病菌产生的尿嘧啶,激活Duox活性和Duox表达通路产生ROS,有利于宿主抵抗病原体感染和维持肠道微生物稳态(图1)。然而,当ROS的浓度超过一定的阈值时,就会产生细胞毒性,此时,诱导免疫调节的过氧化脱氢酶(CAT)表达可以清除肠道中过量的ROS,从而调节机体的氧化平衡。
虽然大多数AMPs受Imd通路的控制,但也有少数AMPs受JAK/STAT通路的调控,如一组AMPs,被鉴定为Drosomycin-like,在前中肠诱导表达。另外,通过JAK/STAT通路可以激活肠道上皮细胞更新,肠道上皮细胞的更新和肠道稳态的维持对于昆虫抵抗致病菌的感染至关重要。
此外,越来越多的研究表明,肠道微生物群可能通过改变肠道的生理功能来保护宿主,比如通过改变pH值和消化酶的水平。此外,肠道微生物群与病原体竞争生存空间和营养,甚至可能产生抗菌物质来限制病原体在肠道内的生存。
原文信息:
Bai, S., Yao, Z. C., Raza, M. F., Cai, Z. H. and Zhang, H. Y. (2021) Regulatory mechanisms of microbial homeostasis in insect gut. Insect Science, 28(2), 286–301.

 打开【阅读原文】
打开【阅读原文】
来源:InsectScience 昆虫科学
原文链接:http://mp.weixin.qq.com/s?__biz=MzIwOTAxMDE2OQ==&mid=2650929795&idx=1&sn=633b0d8e90f074379af61152927398f3
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn